Урок "Алюминий"
-
Алюминий
Сикорская О.Э.
5

Сикорская Ольга Эдуардовна
РСО-Алания г. Владикавказ
МБОУ СОШ № 36
Химия
ЦЕЛЬ УРОКА:
-
Продолжить формирование системы знаний о строении и свойствах металлов.
-
Расширить знания учащихся об алюминии, как элементе и веществе.
-
Способствовать закреплению понимания взаимосвязи строения, свойств и применения веществ.
ЗАДАЧИ УРОКА:
Обучающие
-
Рассмотреть строение атома алюминия.
-
Изучить нахождение алюминия в природе, способы получения и открытие этого элемента, физические и химические свойства, а также применение.
Развивающие
-
Развить умения формулировать гипотезы и проводить их опытную проверку.
-
Продолжить формирование умений обрабатывать и анализировать экспериментальные данные, делать выводы о свойствах вещества.
Воспитывающие
-
Формировать потребности в познавательной деятельности и ценностное отношение к знаниям.
-
Воспитать культуру общения через работу в парах "ученик - ученик", "учитель - ученик".
-
Воспитать у учащихся наблюдательность, внимание, пытливость, инициативу и культуру эксперимента.
ТИП УРОКА: комбинированный урок с демонстрационными и лабораторными опытами, направлен на объяснение нового материала.
СРЕДСТВА ОБУЧЕНИЯ:
-
компьютерная презентация,
-
коллекция "Алюминий",
-
рабочие листы.
ХОД УРОКА
Сегодня нам предстоит познакомиться с веществом хорошо знакомым вам с детства. Давайте попытаемся определить, о каком веществе пойдет речь:
-
Официально открыл его нем. ученый Велер и датск. физик Эрнстед в 1825г.
-
Из-за трудности его получения оно стоило в 1500 раз дороже железа, а через 30 лет кг этого вещества стоил дороже золота.
-
А в XIX веке на императорских приёмах посуда, изготовленная из этого вещества, была самой престижной. Наполеон III устроил однажды банкет, на котором особо почётным гостям выдали ложки и вилки из этого вещества. Гости попроще удостоились обычными для императорского двора золотыми и серебряными приборами. К тому же, только у сына Наполеона III была дорогая по тем временам погремушка, изготовленная из этого вещества».
-
“Однажды к древнеримскому императору Тиберию правившему Римом в 14–27 гг. н. э., пришёл ремесленник и принёс чашу невиданной красоты, изготовленную из серебристого и на удивление лёгкого материала. На вопрос императора что это ремесленник ответил, что материал получен им из…глины и пока не имеет названия. “Дальновидный” император, испугавшись, что новый материал, который можно получать из обыкновенной глины, обесценит серебро и подорвёт могущество Рима, повелел: чашу уничтожить, ремесленника обезглавить, а его мастерскую сравнять с землёй!”
Вы уже догадались, о каком веществе идёт речь? (Алюминий)
Вопрос: Что бы вы сказали, если бы после окончания школы за отличную учёбу и примерное поведение Вас бы премировали алюминиевой кружкой?
Теперь, когда мы определили что этот металл- Al, мы с вами дадим характеристику этого химического элемента по положению в ПС.
Итак, рассмотрим строение атома алюминия. Предлагаю вам определить пропущенные слова в тексте, который имеется у вас в рабочих листах.
-
Порядковый номер алюминия - _______.
-
Алюминий - элемент __________группы, __________ подгруппы
-
Заряд ядра атома алюминия равен ______
-
В ядре атома алюминия __________протонов.
-
В ядре атома алюминия _________нейтронов.
-
В атоме алюминия ________ электронов.
-
Атом алюминия имеет _________энергетических уровня.
-
Электронная оболочка имеет строение __________.
-
На внешнем уровне в атоме алюминия _________ электронов.
-
Степень окисления атома алюминия в соединениях равна ________.
-
Простое вещество алюминий является ____________.
-
Оксид и гидроксид алюминия имеют ___________________ характер.
Теперь попытаемся определить физические свойства алюминия.
Лабораторная работа по теме: “Физические свойства алюминия”.
Работу выполняют в группах. Работают по инструктивным карточкам. (Самостоятельная работа учащихся с образцами алюминия по инструктивной карточке.)
Рассмотрите алюминиевую пластинку, ответьте на вопросы:
-
Каково агрегатное состояние алюминия?
-
Каков цвет алюминия?
-
Имеется ли блеск?
-
Какова плотность алюминия?
-
Обладает ли алюминий пластичностью?
-
Лёгкий ли это металл?
-
Прочный ли металл алюминий?
-
Наблюдается ли растворение алюминия в воде?
-
Обладает ли алюминий теплопроводностью? А электропроводностью?
-
Обладает ли алюминий магнитными свойствами?
Учитель
(обобщает). Алюминий легкий металл, серебристо – белого цвета, с металлическим блеском. Плотность – 2,7г/см3,твердость – 2,9, пластичный, обладает высокой теплопроводностью и электропроводностью, не обладает магнитными свойствами, t0пл =6600С.
Благодаря чему алюминий обладает такими свойствами? (Благодаря строению кристаллической решетки)
? А какова
кристаллическая решетка алюминия
(металлическая)
? Какова химическая
связь в металле? (металлическая)
Химические свойства алюминия.
Учитель
Какими химическими свойствами должен обладать алюминий, исходя из его положения в периодической системе Д.И. Менделеева, и сравнивая строение атомов элементов III периода?
Ответы:
В периоде с увеличением заряда ядра атома уменьшается радиус атома и способность элемента отдавать электроны тоже уменьшается, поэтому алюминий проявляет более слабые восстановительные (металлические) свойства, чем натрий и магний, он относится к переходным металлам и занимает промежуточное положение между металлами и неметаллами, его соединения являются амфотерными.
Учитель: Поверхность алюминия покрыта защитной оксидной плёнкой, которая защищает металл от воздействия компонентов воздуха и воды.
Взаимодействие алюминия с неметаллами, кислотами и щелочами.
Ученики записывают уравнения реакции: 4Al + 3O2 →2Al2O3
2Al +3Cl2 → 2AlCl3
2Al + 3S → Al2S3
2Al + N2 → 2AlN
В уравнениях реакций ученики отмечают степени окисления алюминия до и после реакции и делают вывод, что алюминий в реакциях является восстановителем как и другие металлы.
Взаимодействие алюминия со сложными веществами.
Работа с виртуальной лабораторией.
Учитель: если с алюминия удалить оксидную пленку, то алюминий должен проявлять свойства аналогичные щелочноземельным металлам. Ученики пишут уравнение реакции взаимодействия алюминия с водой по аналогии со щелочными и щелочноземельными металлами и отмечают условия реакции (удалить с поверхности металла оксидную пленку)
2Al + 6H2O → 2Al(OH)3 + 3H2
Учитель:
Запомните, что в обычных условиях оксидная пленка защищает алюминий от разрушения(коррозии).
Алюминий будет вытеснять водород, т.к. в ряду напряжения металлов он стоит правее водорода.
Учитель:
Действительно алюминий взаимодействует с растворами кислот с выделением водорода. А концентрированные серная и азотная кислоты пассивируют поверхность алюминия, образуя на его поверхности прочную оксидную пленку, которая препятствует дальнейшему протеканию реакции. Поэтому эти кислоты перевозят в алюминиевых цистернах.
Запишите уравнение реакции взаимодействия алюминия с соляной кислотой в рабочих листах.
Основываясь на то, что алюминий - переходный металл, подумайте, с какими еще сложными веществами может взаимодействовать алюминий? С растворами щелочей.
Учитель:
Давайте вместе запишем уравнение реакции взаимодействия алюминия с раствором гидроксида натрия.
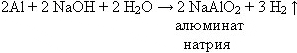
Учитель:Что такое алюминотермия?
Ученик: Алюминотермия - это способ восстановления многих металлов из их оксидов с помощью алюминия, если в электрохимическом ряду напряжения металл расположен после алюминия.
Учитель: Как вы думаете, будет ли протекать следующая реакция?
Al + Fe3O4 = ?
Итак, алюминий находится в начале ряда напряжений сразу после щелочных и щелочноземельных металлов, поэтому он проявляет высокую химическую активность.
Алюминий является активным металлом, реагирует с простыми веществами- неметаллами. Из сложных соединений алюминий восстанавливает ионы водорода и ионы менее активных металлов. Однако при комнатной температуре на воздухе алюминий не изменяется, так как покрыт защитной оксидной пленкой.
Мы с вами рассмотрели строение, физические и химические свойства металла. На следующем уроке мы познакомимся с получением и применением этого металла.
В заключении урока учащиеся выполняют тест.
Домашнее задание.
параграф 13 до стр.60; Вопросы 1,2,3 на стр. 62.
Использованная литература.
1. Дидактические игры при обучении химии / Г.И. Штремплер, Г.А.Пичугина. 2-е изд., стереотип. М.: Дрофа, 2005.
2. Леенсон И.А. 100 вопросов и ответов по химии. Учебное пособие. М., ООО «Издательство АСТ», 2002.
3. П. Бенеш и др 111 вопросов по химии… для всех. Кн. для учащихся. М.: Просвещение, 1994.
4. Пичугина Г.В. Химия и повседневная жизнь человека. М., Дрофа, 2004.
5. Венецкий С. И. В мире металлов. М.: Металлургия, 1988, с. 168.
6. Габриелян О. С. Химия. Методическое пособие 8-9 классы, М.: Дрофа, 1998, 126 с.
7. Габриелян О. С., Остроумов И. Г. Настольная книга учителя. Химия 9 класс, М.: Дрофа,2003, 398 с.
Заполните пропуски:
-
Порядковый номер алюминия - _______.
-
Алюминий - элемент __________группы, __________ подгруппы
-
Заряд ядра атома алюминия равен ______
-
В ядре атома алюминия __________протонов.
-
В ядре атома алюминия _________нейтронов.
-
В атоме алюминия ________ электронов.
-
Атом алюминия имеет _________энергетических уровня.
-
Электронная оболочка имеет строение __________.
-
На внешнем уровне в атоме алюминия _________ электронов.
-
Степень окисления атома алюминия в соединениях равна ________.
-
Простое вещество алюминий является ____________.
-
Оксид и гидроксид алюминия имеют ___________________ характер.
Лабораторная работа.
Рассмотрите алюминиевую пластинку, ответьте на вопросы:
-
Каково агрегатное состояние алюминия?
-
Каков цвет алюминия?
-
Имеется ли блеск?
-
Какова плотность алюминия?
-
Обладает ли алюминий пластичностью?
-
Лёгкий ли это металл?
-
Прочный ли металл алюминий?
-
Наблюдается ли растворение алюминия в воде?
-
Обладает ли алюминий теплопроводностью? А электропроводностью?
-
Обладает ли алюминий магнитными свойствами?
- Международный вебинар «Волонтёрство и новые воспитательные практики в школе»
- Международный вебинар «Обучение грамоте старших дошкольников с помощью развивающих игр В. В. Воскобовича: практика реализации ФГОС и ФОП ДО»
- Вебинар «Социально-коммуникативное развитие детей дошкольного возраста в условиях реализации ФОП ДО и обновлённого ФГОС ДО»
- Международный вебинар «Цель и преимущества использования ТРИЗ-технологии в дошкольном образовании в условиях реализации ФОП ДО»
- Вебинар «Кинезиологические игры и упражнения в развитии психических процессов дошкольников»
- Психология профессионального образования: общая характеристика