Урок химии по теме "Строение и номенклатура алкенов"
Цели и задачи занятия:
- образовательные: закрепить понятие о гомологии; ознакомить учащихся с гомологическим рядом непредельных углеводородов – алкенов; дать представление об электронном строении алкенов; ввести понятие о новых видах изомерии в органических соединениях; познакомить учащихся с современной номенклатурой алкенов;
- развивающие: развивать познавательные способности учащихся и способности к самообучению с помощью компьютера;
- воспитательные: воспитывать информационную культуру учащихся.
План урока.
| Этапы занятия (краткое содержание деятельности учителя и учащегося) | Временная реализация |
| 1. Организационный момент | 1 минута |
| 2. Целевая установка (объявление темы и задач урока) | 2 минуты |
| 3. Актуализация знаний. Задача – проверка знаний учащихся, полученных ранее | 3 минуты |
| 4. Изучение нового материала. Цель – решение поставленных образовательных задач | 15 минут |
| 5. Задание. Задача – закрепление полученных знаний о номенклатуре алкенов. | 5 минут |
| 6. Обобщение изученного материала. Задача – убедиться в усвоении учащимися предложенной на уроке темы | 4 минуты |
| 7. Тест на компьютере «Строение и номенклатура алкенов». Задача – закрепление полученных знаний и понятий | 10 минут |
| 8. Краткое обобщение и анализ проделанной работы в форме беседы. Задача – убедиться в усвоении учащимися предложенной темы | 4 минуты |
| 9. Домашнее задание | 1минута |
Ход занятия.
Организационный момент.
- Целевая установка.
Задачи урока: — познакомиться с гомологическим рядом этилена
— изучить электронное строение алкенов
— познакомиться с новыми видами изомерии у непредельных углеводородов и их номенклатурой
— закрепить полученные знания на практике.
- Актуализация знаний учащихся.
- Что такое гомологи? (слайд №4)
- Что такое гомологи? (слайд №4)
- Какие гомологические ряды были изучены ранее? Каковы их общие формулы?
- Какой тип гибридизации электронных облаков и какой валентный угол характерны для алканов?
- Почему алканы и циклоалканы относятся к предельным, или насыщенным, углеводородам
- Изучение нового материала.
Р
авноценны ли обе связи между атомами углерода? Экспериментально установлено различие в энергии связей. Более прочная связь называется б-, а менее прочная – π- связью. (слайд №5)
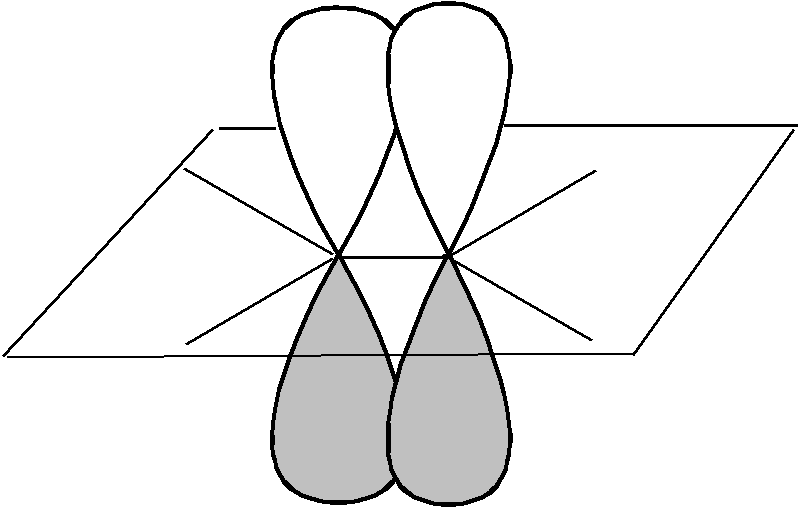
Рассмотрим образование б- и π- связей в молекуле этилена. (слайд №6) Атомы углерода в молекуле этилена находятся в sp2-гибридизации, т.е. 1s и 2p-электронные облака образуют три sp2 — гибридных облака, которые, максимально удаляясь друг от друга в пространстве, располагаются в одной плоскости под углом 120°. Одно из этих облаков перекрывается с таким же облаком второго атома углерода, а два других – с s-облаками атомов водорода, образуя б-связи. Негибридизованные же облака атомов углерода перекрываются между собой, выше и ниже плоскости атомных ядер, образуя π-связь. Однако такое боковое перекрывание электронных облаков происходит в меньшей степени, чем облаков, взаимодействующих в направлении прямой, соединяющей центры атомов, потому π -связь оказывается менее прочной, чем б-связь. Но её появление в молекуле сближает атомы углерода и расстояние между их центрами составляет уже 0,134 нм. (у предельных 0,154).
С 1s2 2s1 2p3 1s + 2p 3sp2
Учитель демонстрирует шаростержневые модели молекул этана и этилена и учащиеся убеждаются в невозможности свободного вращения атомов углерода вокруг двойной связи.
Этилен открывает собой гомологический ряд этиленовых углеводородов (алкенов) (слайд №7)
| Молекулярная формула | Название |
| С2Н4 | этен (этилен) |
| С3Н6 | пропен |
| С4Н8 | бутен |
| С5Н10 | пентен |
| ……… | ……… |
Какова общая формула алкенов? (слайд 8)
Общая формула алкенов CnH2n.
Какие углеводороды имеют такую же общую формулу? (циклопарафины)
Такое явление называется межклассовой изомерией.
Итак, появление двойной связи повлекло за собой возникновение новых видов изомерии у алкенов: изомерия углеродного скелета, положения кратной связи, межклассовая,
пространственная (цис-транс-изомерия). (слайд №9)
1. Изомерия углеродного скелета
СН2=СН-СН2-СН3 и СН2=С-СН3
СН3
2. Изомерия положения кратной связи
СН2=СН-СН2-СН3 и СН3-СН=СН-СН3
3 СН2
СН2
. Межклассовая
С СН2
СН2
Н2=СН-СН2-СН3 и
4 CH3
Пространственная (цис-транс-изомерия)
Все изомеры имеют разное строение и должны по-разному называться.
Правила номенклатуры алкенов (слайд №10)
- Выделяют в структурной формуле наиболее длинную цепь атомов углерода, включающую двойную связь, и нумеруют их с того конца, к которому ближе двойная связь.
- В начале названия цифрой указывают положение замещающей группы (радикала).
- Если замещающих групп несколько, цифрами отмечают каждую из них.
- После названия замещающей группы (радикала) называют всю неразветвлённую углеродную цепь.
- В конце названия обозначают положение двойной связи номером того атома углерода, от которого она начинается.
СН3-С=СН-СН3 2-метилбутен-2
СН3
5. Задание.
А теперь дайте название всем углеводородам, формулы которых были приведены выше без названий. (слайды №11-14)
6. Обобщение изученного материала.
- С какими углеводородами вы познакомились сегодня на уроке? Почему они относятся к непредельным? (Алкены относятся к непредельным потому что их молекулы не до предела насыщены атомами водорода.)
- Какова общая формула алкенов? (CnH2n)
- От чего происходят названия алкенов?
- Сравните тип гибридизации, валентный угол, расстояние между атомами углерода и молекулах алканов и алкенов. (слайд №15-16)
- Что особенного в строении молекул алкенов? (наличие двойной связи)
- Каковы последствия появления двойной связи в молекулах алкенов? (появляются новые виды изомерии: межклассовая, пространственная и положения кратной связи)
7. Тест на компьютере (Приложение1)
Запуск тестирующей системы на каждом компьютере – файл Test.test. Ученикам предлагается проверить усвоение полученных знаний с помощью теста на компьютере. В тесте используются вопросы с выборочной формой ответа. Среда ADSoft Tester 2.6.0, в которой выполнен тест, даёт возможность проанализировать ошибки, допущенные в ответах.
/после выполнения теста учащиеся переходят от компьютеров к партам/
8.Краткое обобщение и анализ проделанной работы в форме беседы.
Проверяется правильность выполнения тестов учащимися, акцентируется внимание на вопросах, вызвавших у них затруднения. (слайды №17-21)
9.Домашнее задание.
Учебник Л.А. Цветкова §10,11, упр.10,11 стр.53 (слайд №22)
Томская область Бакчарский район
МОУ «Парбигская средняя общеобразовательная школа»
План – конспект
медиаурока химии в 10 классе
на тему
«Строение и номенклатура алкенов».
Урок разработан учителем химии
Дьяченко Людмилой
Александровной
Тема урока: «Строение и номенклатура алкенов»
Цели и задачи занятия:
-
образовательные: закрепить понятие о гомологии; ознакомить учащихся с гомологическим рядом непредельных углеводородов – алкенов; дать представление об электронном строении алкенов; ввести понятие о новых видах изомерии в органических соединениях; познакомить учащихся с современной номенклатурой алкенов;
-
развивающие: развивать познавательные способности учащихся и способности к самообучению с помощью компьютера;
-
воспитательные: воспитывать информационную культуру учащихся.
Необходимое оборудование и материалы для занятия – компьютеры, проектор, шаростержневые модели молекул этана и этилена, раздаточные таблицы с правилами номенклатуры алкенов. Презентация урока.
План урока.
|
Этапы занятия (краткое содержание деятельности учителя и учащегося) |
Временная реализация |
|
1. Организационный момент |
1 минута |
|
2. Целевая установка (объявление темы и задач урока) |
2 минуты |
|
3. Актуализация знаний. Задача – проверка знаний учащихся, полученных ранее |
3 минуты |
|
4. Изучение нового материала. Цель – решение поставленных образовательных задач |
15 минут |
|
5. Задание. Задача – закрепление полученных знаний о номенклатуре алкенов. |
5 минут |
|
6. Обобщение изученного материала. Задача – убедиться в усвоении учащимися предложенной на уроке темы |
4 минуты |
|
7. Тест на компьютере «Строение и номенклатура алкенов». Задача – закрепление полученных знаний и понятий |
10 минут |
|
8. Краткое обобщение и анализ проделанной работы в форме беседы. Задача – убедиться в усвоении учащимися предложенной темы |
4 минуты |
|
9. Домашнее задание |
1минута |
Ход занятия.
-
Организационный момент.
На предыдущих уроках, ребята, мы изучали предельные углеводороды. Но мир углеводородов очень многообразен и кроме предельных существует ещё большая группа непредельных и ароматических углеводородов (слайд №2)
-
Целевая установка.
Тема нашего урока: «Строение и номенклатура алкенов» (слайд №3)
Задачи урока: - познакомиться с гомологическим рядом этилена
- изучить электронное строение алкенов
- познакомиться с новыми видами изомерии у непредельных углеводородов и их номенклатурой
- закрепить полученные знания на практике.
-
Актуализация знаний учащихся.
-
Что такое гомологи? (слайд №4)
-
-
Какие гомологические ряды были изучены ранее? Каковы их общие формулы?
-
Какой тип гибридизации электронных облаков и какой валентный угол характерны для алканов?
-
Почему алканы и циклоалканы относятся к предельным, или насыщенным, углеводородам?
-
Изучение нового материала.
Существуют углеводороды, в молекулах которых атомы углерода не до предела насыщены водородом и потому называются непредельными. К ним относятся этилен, формула которого С2Н4. Как же, согласно теории химического строения А.М. Бутлерова, должны соединяться атомы в этой молекуле? Попробуйте составить электронную и структурную формулу этилена. (Учащиеся приходят к выводу, что в молекуле этилена содержится двойная связь между атомами углерода)
Р
Рассмотрим образование б- и π- связей в молекуле этилена. (слайд №6) Атомы углерода в молекуле этилена находятся в sp2-гибридизации, т.е. 1s и 2p-электронные облака образуют три sp2- гибридных облака, которые, максимально удаляясь друг от друга в пространстве, располагаются в одной плоскости под углом 120°. Одно из этих облаков перекрывается с таким же облаком второго атома углерода, а два других – с s-облаками атомов водорода, образуя б-связи. Негибридизованные же облака атомов углерода перекрываются между собой, выше и ниже плоскости атомных ядер, образуя π-связь. Однако такое боковое перекрывание электронных облаков происходит в меньшей степени, чем облаков, взаимодействующих в направлении прямой, соединяющей центры атомов, потому π -связь оказывается менее прочной, чем б-связь. Но её появление в молекуле сближает атомы углерода и расстояние между их центрами составляет уже 0,134 нм. (у предельных 0,154).
С
![]() 1s2
2s1
2p3
1s + 2p
3sp2
1s2
2s1
2p3
1s + 2p
3sp2
![]()
![]()
![]()
Вступают в
гибридизацию
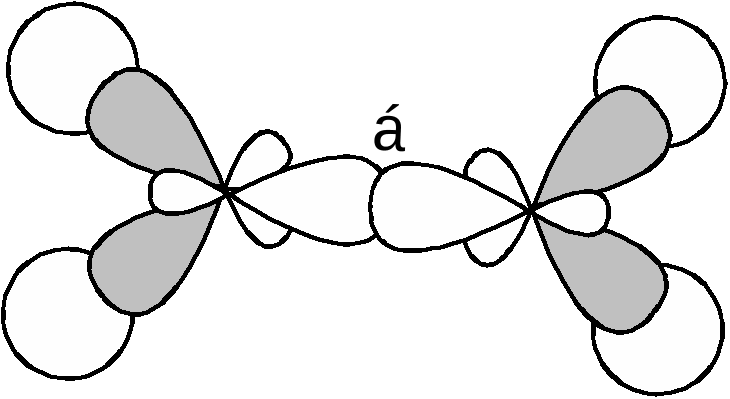
Учитель демонстрирует шаростержневые модели молекул этана и этилена и учащиеся убеждаются в невозможности свободного вращения атомов углерода вокруг двойной связи.
Этилен открывает собой гомологический ряд этиленовых углеводородов (алкенов) (слайд №7)
|
Молекулярная формула |
Название |
|
С2Н4 |
этен (этилен) |
|
С3Н6 |
пропен |
|
С4Н8 |
бутен |
|
С5Н10 |
пентен |
|
……… |
……… |
По систематической номенклатуре названия углеводородов происходят от названий предельных углеводородов путём изменения суффикса –ан на –ен.
Какова общая формула алкенов? (слайд 8)
Общая формула алкенов CnH2n.
Какие углеводороды имеют такую же общую формулу? (циклопарафины)
Такое явление называется межклассовой изомерией.
Итак, появление
двойной связи повлекло за собой
возникновение новых видов изомерии у
алкенов: изомерия углеродного скелета,
положения кратной связи, межклассовая,
1. Изомерия углеродного скелета
 СН2=СН-СН2-СН3
и СН2=С-СН3
СН2=СН-СН2-СН3
и СН2=С-СН3
СН3
2. Изомерия положения кратной связи
СН2=СН-СН2-СН3 и СН3-СН=СН-СН3
3
СН2 СН2 .
Межклассовая
.
Межклассовая
С
СН2 СН2
4
CH3
H H H

CH3 H CH3 CH3
Все изомеры имеют разное строение и должны по-разному называться.
Правила номенклатуры алкенов (слайд №10)
-
Выделяют в структурной формуле наиболее длинную цепь атомов углерода, включающую двойную связь, и нумеруют их с того конца, к которому ближе двойная связь.
-
В начале названия цифрой указывают положение замещающей группы (радикала).
-
Если замещающих групп несколько, цифрами отмечают каждую из них.
-
После названия замещающей группы (радикала) называют всю неразветвлённую углеродную цепь.
-
В конце названия обозначают положение двойной связи номером того атома углерода, от которого она начинается.
Пример: 1 2 3 4
 СН3-С=СН-СН3
2-метилбутен-2
СН3-С=СН-СН3
2-метилбутен-2
СН3
5. Задание.
А теперь дайте название всем углеводородам, формулы которых были приведены выше без названий. (слайды №11-14)
6. Обобщение изученного материала.
-
С какими углеводородами вы познакомились сегодня на уроке? Почему они относятся к непредельным? (Алкены относятся к непредельным потому что их молекулы не до предела насыщены атомами водорода.)
-
Какова общая формула алкенов? (CnH2n)
-
От чего происходят названия алкенов?
-
Сравните тип гибридизации, валентный угол, расстояние между атомами углерода и молекулах алканов и алкенов. (слайд №15-16)
-
Что особенного в строении молекул алкенов? (наличие двойной связи)
-
Каковы последствия появления двойной связи в молекулах алкенов? (появляются новые виды изомерии: межклассовая, пространственная и положения кратной связи)
/ Учащиеся переходят от парт к компьютерам/
7. Тест на компьютере (Приложение1)
Запуск тестирующей системы на каждом компьютере – файл Test.test. Ученикам предлагается проверить усвоение полученных знаний с помощью теста на компьютере. В тесте используются вопросы с выборочной формой ответа. Среда ADSoft Tester 2.6.0, в которой выполнен тест, даёт возможность проанализировать ошибки, допущенные в ответах.
/после выполнения теста учащиеся переходят от компьютеров к партам/
8.Краткое обобщение и анализ проделанной работы в форме беседы.
Проверяется правильность выполнения тестов учащимися, акцентируется внимание на вопросах, вызвавших у них затруднения. (слайды №17-21)
9.Домашнее задание.
Учебник Л.А. Цветкова §10,11, упр.10,11 стр.53 (слайд №22)
Тест
1) Вещества с общей формулой СnH2n относятся к классу
-
алканов
-
алкинов
-
алкенов
-
аренов
2) Гомологом этилена является
-
C6H6
-
CH3-CH=CH2
-
C2H4
-
CH3-CH2-CH3
3) π-связь имеется в молекуле
-
пентана
-
циклопентана
-
2-метилпропана
-
пропена
4 )
Углеводород с формулой СН3-СН-СН=СН-СН3
называется
)
Углеводород с формулой СН3-СН-СН=СН-СН3
называется
CH3
-
2-метилпентан
-
2-метилпентен-3
-
4-метилгексен-2
-
4-метилпентен-2
5) Изомерами являются
-
С
CH3
Н3-СН2-СН2-СН3 и СН3-СН=СН-СН3

-
С
CH3
 Н2=С-СН2-СН3
и СН3-СН=С-СН3
Н2=С-СН2-СН3
и СН3-СН=С-СН3
-
СН3-СН2-СН3 и СН3-СН2-СН2-СН3
-
СН2=СН-СН3 и СН3-СН2-СН3
- Международный вебинар «Волонтёрство и новые воспитательные практики в школе»
- Вебинар «Социально-коммуникативное развитие детей дошкольного возраста в условиях реализации ФОП ДО и обновлённого ФГОС ДО»
- Международный вебинар «Обучение грамоте старших дошкольников с помощью развивающих игр В. В. Воскобовича: практика реализации ФГОС и ФОП ДО»
- Вебинар «Кинезиологические игры и упражнения в развитии психических процессов дошкольников»
- Международный вебинар «Цель и преимущества использования ТРИЗ-технологии в дошкольном образовании в условиях реализации ФОП ДО»
- Психология профессионального образования: общая характеристика




В презентации на нескольких слайдах -сбой в графических изображениях формул (в тексте конспекта урока, кстати тоже).