














Урок
вне КТП
23.10.19 10
класс ХИМИЯ
Методика решения расчетных задач повышенной сложности по химии
Требования к ЗУН:
Образовательные: учиться работать с условием задач, в том числе повышенной сложности и составлять план их решения;
Развивающие: развивать навыки использования теоретических знаний о химических и физических явлениях, а также абстрактного мышления для решения задач;
Воспитательные: воспитывать внимательность к деталям и умение получать информацию категории «между строк».
Оборудование: презентация, раздаточный материал с условием задачи и ориентировочными абстрактными картинками к ней.
Ход урока:
1. Организационный этап
На столе:
-
Тетрадь
-
Ручка
-
Карандаш
К уроку Вам необходимо было подготовить:
-
Калькулятор
2. Актуализация опорных знании
Задачи - особый вид заданий, требующий от обучающихся применения знаний в составлении уравнений реакций, иногда нескольких, составления логической цепочки в проведении расчётов.
Все экспериментальные и теоретические достижения естественных наук рано или поздно находят применение в промышленности.
Химик-теоретик подготовит путь химику-практику.
3. Постановка целей урока
Тема урока «Решение расчетных задач по химии»
Цели урока:
• Разобрать алгоритм решения расчетны задач
• Применить алгоритм решения на задаче повышенного уровня сложности
4. Применение знаний
Порядок решении задач - АЛГОРИТМ
1. Анализ текста
-
Построение абстрактной картинки по условию
-
Перевод текста на химический язык
-
Краткая запись условия задачи («ДАНО»)
2. Запись уравнения химической реакции
3. Запись известных и неизвестны величин, из «дано», н
4. Запись известных величин, из уравнения реакции, под ч' Молярной массы f
-
Молярный объема
-
Количества веществ
5. Решение задачи (2 части: I) химическая и II) математическая)
Химическая часть задачи
1. Чтение текста
2. Запись условия задачи
3. Определение типа задачи
4. Анализ задачи - составление плана решения
Математическая часть задачи
1. Выбор способа решения
2. Решение
3. Запись ответа
4. Анализ решения
Но внимание сегодня мы уделим не базовым задачам, а тем; которые носят статус «задач повышенного уровня сложности»
Вопрос: в чем для Вас заключается разница между задачами базовыми и повышенного уровня сложности?
Предположительный ответ: в том, что базовые опираются. на школьную программу, а сложные подразумевают сочетание разных типов задач и/или запутанное условие.
Чтобы успешно сдать ЕГЭ по химии умение решать базовые задачи поможет в большинстве из 35 заданий, и лишь №34 содержит задачу нестандартного хода решения.
Решение расчетных задач
по химии повышенного уровня сложности
Приложение 1

-
Анализ условия задачи – семантический, логический, математический

Задача требует внимания к 2м частям своего условия: в одной смесь перевели в состояние раствора, в другой – осталась сухой смесь.

РАБОТА С РАСТВОРОМ СМЕСИ:

-
Построение абстрактной картинки (приложение 2)
-
Соотношение данных и вопроса
-
Оформление краткого условия
|
Дано: mсм. = 65 г. mос. = 93,2 г. |
|
|
РАБОТА С СУХОЙ СМЕСЬЮ

-
Построение абстрактной картинки (приложение 3)
-
Соотношение данных и вопроса

-
Оформление краткого условия
|
Дано: mсм. = 65 г. m р-ра NH3 = 47,6 г. w NH3/р-ре = 25 % |
|
|
ОБЩИЙ ВИД КРАТКОГО УСЛОВИЯ ЗАДАЧИ
|
Дано: mсм. = 65 г. mос. = 93,2 г. m р-ра NH3 = 47,6 г. w NH3/р-ре = 25 % |
|
w Na2SO4 = ? w (NH4)2SO4 = ? w NH4Cl = ? |
-
Построение абстрактной картинки (приложение 4)
-
Запись уравнения химической реакции

NH4Cl + BaCl2 →
(NH4)2SO4 + BaCl2 → BaSO4 + 2NH4Cl
Na2SO4 + BaCl2 → BaSO4 + 2NaCl

NH4Cl + NaOH → NaCl + NH3↑+Н2О
(NH4)2SO4 + 2NaOH →Na2SO4+ 2NH3↑+Н2О
Na2SO4 + NaOH →
-
Решение задачи
1 этап. Химический
Определили реакции, которые будут протекать
а) с хлоридом бария
1. (NH4)2SO4 + BaCl2 → BaSO4↓+ 2NH4Cl
2. Na2SO4 + BaCl2 → BaSO4 ↓ + 2NaCl
б) с гидроксидом натрия
3. NH4Cl + NaOH → NaCl + NH3↑+Н2О
4. (NH4)2SO4 + 2NaOH → Na2SO4+ 2NH3↑+Н2О

2 этап. Математический

1 этап. Химический
осадок газ

2 этап. Математический

В целях экономии времени ход решения системы уравнений останется Вам на Д/з (сделать пометку на полях).
После решения системы и приведения уравнения к одному неизвестному (z), мною получен результат:
z = 0,18 NH4Cl
у = 0,072 (NH4)2SO4
х = 0,55 Na2SO4
11. Массы компонентов смеси m = n × M
m (NH4)2SO4 = 0,55 × 53,5 = 29,5 г.
m Na2SO4 = 0,072 × 132 = 9,5 г.
m NH4Cl = 0,18 × 142 = 26 г.
12.
Доли
компонентов смеси, как w
=
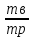 ×
100%
×
100%
w (NH4)2SO4 = 29,5/65 = 45,4%
w Na2SO4 = 9,5/65 = 14,6%
w NH4Cl = 26/65 = 40%
5. Подведение итогов урока
6. Рефлексия
Оценим его результативность «дело», свою работу «Я» и общую активность класс «коллектив». Второй график в виде мишени состоит из 4х частей и на нем мы покажем своё ощущение в конце урока и уровень в каждой из стихий: было понятно, узнал новое, было интересно и активно участвовал отметкой от 2 до 5.
7. Д/з
в файликах на Ваших столах находится конверт с домашним заданием, где приведено условие задачи и описана процедура работы с ней.
Приложение 1.
Задача урока

Приложение 2.
Na2SO4
(NH4)2SO4
NH4Cl
65 г.
смесь
Смешали компоненты
К р-ру добавили
BaCl2
ВОДА
Растворили в воде
Образовался осадок
Приложение 3.
Na2SO4
(NH4)2SO4
NH4Cl
смесь
Смешали компоненты
К смеси добавили
NaOH
NH3
?%
Na2SO4
(NH4)2SO4
NH4Cl
смесь
?% ?%
Приложение 4.
РАБОТА
С РАСТВОРОМ СМЕСИ mсм.
= 65 г. mос.
=
93,2 г.
РАБОТА
С СУХОЙ СМЕСЬЮ mсм.
= 65 г. m
р-ра
NH3
= 47,6 г. w
NH3/р-ре
= 25 %
?%
Na2SO4
(NH4)2SO4
NH4Cl
смесь
?% ?%
-
Домашнее задание
-
Прочитать задачу
-
Проанализировать текст
-
Составить краткое условие
-
Записать необходимые уравнения реакции
-
Попробовать решить задачу
-

Учитель химии и биологии в МБОУ "Абрикосовская школа" Жданова Е.В.
- Международный вебинар «Обучение грамоте старших дошкольников с помощью развивающих игр В. В. Воскобовича: практика реализации ФГОС и ФОП ДО»
- Вебинар «Социально-коммуникативное развитие детей дошкольного возраста в условиях реализации ФОП ДО и обновлённого ФГОС ДО»
- Международный вебинар «Волонтёрство и новые воспитательные практики в школе»
- Психология профессионального образования: общая характеристика
- Международный вебинар «Цель и преимущества использования ТРИЗ-технологии в дошкольном образовании в условиях реализации ФОП ДО»
- Вебинар «Кинезиологические игры и упражнения в развитии психических процессов дошкольников»