МУНИЦИПАЛЬНОЕ
БЮДЖЕТНОЕ ОБЩЕОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ
МО Г. НЯГАНЬ
МУНИЦИПАЛЬНОЕ
БЮДЖЕТНОЕ ОБЩЕОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ
МО Г. НЯГАНЬ
«СРЕДНЯЯ ОБЩЕОБРАЗОВАТЕЛЬНАЯ ШКОЛА № 6»
Рассмотрено: Согласовано: Утверждаю:
на заседании ШМО заместитель директора директор МБОУ
предметов образовательной по УВР_Ткачук Л.Э. «СОШ № 6»_______
области «Естествознание» О.Г.Волоснёв
протокол № ____ _________________ приказ № ______
«___»_____2013г «___»__________2013г от «__» августа_2013г
РАБОЧАЯ ПРОГРАММА
(наименование предмета)
в 11 в классе
профильный уровень
Разработали:
Ким Н.В. учитель химии
высшей квалификационной категории
МБОУ г. Нягань «СОШ №6»
г. Нягань
2013 г.
РАБОЧАЯ ПРОГРАММА КУРСА ХИМИИ
Допущено Министерством образования и науки Российской Федерации
для профильного изучения химии в XI классе общеобразовательных учреждений (профильный уровень)
Авторы: И. Г. Остроумов, О. С. Габриелян
ОБЩАЯ ХИМИЯ
11 класс
ПК — 4 ч в неделю; всего 136 ч
ПОЯСНИТЕЛЬНАЯ ЗАПИСКА
Программа по химии для XI класса разработана на основе концентрического подхода к структурированию учебного материала, так как в основной школе уже рассматривались первоначальные сведения об неорганических и органических веществах при изучении химии в VIII и в IX классах.
Принимая концентризм как методологию в построении курса химии старшей школы, авторы широко использовали его при составлении своей программы и для определения структуры профильного курса химии.
Содержание курса общей химии на новом уровне позволяет рассмотреть сведения по общей, неорганической и органической химии, данные в основной школе, более основательно. Курс общей химии, изучаемый на заключительном этапе школьного образования, дает возможность не только обобщить на более высоком уровне знания учащихся по неорганической и органической химии на основе общих понятий, законов и теорий химии, но и сформировать единую химическую картину мира как неотъемлемую часть естественно-научной картины мира. Схематически предложенный курс может быть представлен следующим образом:
Разрабатывая программу для профильного естественно-научного изучения химии, авторы не могли не учесть того, что подавляющему большинству выпускников таких классов и школ предстоит успешно выдержать Единый государственный экзамены по окончании изучения курса. Кроме этого, выпускникам предстоит обучении в ВУЗах, в которых химия является профилирующим предметом, поэтому им необходима основательная школьная подготовка к изучению целого ряда вузовских химических дисциплин. В связи с этим авторы создавали курс на основе квантово-механических, структурных, термодинамических и кинетических представлений современной химической науки, адаптируя эти ее разделы к средней школе.
Программа по химии для XI класса общеобразовательных учреждений — логическое продолжение курса основной школы, поэтому она разработана с опорой на курс химии VIII— IX классов. Некоторые, преимущественно теоретические, темы основного курса химии рассматриваются снова, но уже на более высоком уровне, расширенно и углубленно. Авторы сделали это осознанно, с целью формирования единой целостной химической картины мира и для обеспечения преемственности между основной и старшей ступенями обучения в общеобразовательных учреждениях.
Курс общей химии изучается в XI классе и направлен на интеграцию знаний учащихся по неорганической и органической химии на самом высоком уровне общеобразовательной школы. Ведущая идея курса — целостность неорганической и органической химии на основе общности их понятий, законов и теорий, а также единых подходов к классификации органических и неорганических веществ и закономерностям протекания химических реакций. Такое построение курса общей химии позволяет подвести учащихся к пониманию материальности и познаваемости единого мира веществ, причин его красочного многообразия, всеобщей связи явлений.
Все это дает учащимся возможность не только лучше усвоить собственно химическое содержание, но и понять роль и место химии в системе наук о природе. Структура курса позволяет в полной мере использовать в обучении логические операции мышления: анализ и синтез, сравнение и аналогию, систематизацию и обобщение.
Значительное место в содержании курса отводится химическому эксперименту. Он дает возможность формировать у учащихся специальные предметные умения при работе с химическими веществами, выполнении простых химических опытов, а также учить школьников безопасному и экологически грамотному обращению с веществами в быту и на производстве. Практические работы служат средством не только закрепления умений и навыков, но и контроля за качеством их сформированности.
По своему усмотрению, а также исходя из возможностей школьного кабинета химии, учитель может изменить структуру представленного в программе практикума; например, увеличить число лабораторных работ за счет сокращения демонстраций или распределить работы в соответствии со своей логикой изучения курса.
Курс общей химии рассчитан на 136 часов (4 ч в неделю) для классов и школ естественнонаучного или химико-биологического профиля.
Исходными документами для составления рабочей программы явились:
-
БУП – 2004, утвержденный приказом Минобразования РФ № 1312 от 05.03.2004;
-
Федеральный компонент государственного образовательного стандарта, утвержденный приказом Минобразования РФ № 1089 от 09.03.2004;
-
Федеральный перечень учебников, рекомендованных (допущенных) к использованию в образовательном процессе в образовательных учреждениях, реализующих программы общего образования, утвержденного приказом № 379 от 09.12.2008 г;
-
Федеральная примерная программа среднего (полного) общего образования по химии, созданная на основе федерального компонента государственного образовательного стандарта;
-
Письмо Минобрнауки России от 01.04.2005 № 03-417 «О перечне учебного и компьютерного оборудования для оснащения образовательных учреждений»(« Вестник образования», 2005, № 11 или сайт http:/www.vestnik.edu.ru).
Рабочая программа разработана на основе авторской программы О.С. Габриеляна, соответствующей Федеральному компоненту государственного стандарта общего образования и допущенной Министерством образования и науки Российской Федерации. (Габриелян О.С. Программа курса химии для 8-11 классов общеобразовательных учреждений / О. С. Габриелян. – 2-е изд., перераб. и доп. – М.: Дрофа, 2005.).
В авторскую программу внесены следующие изменения:
-
Введение в курс химии 11 класса начинается с темы «Методы научного познания», уменьшенного на 2 ч., для актуализации знаний, полученных в 8-10 классах.
-
Увеличено число часов: на 2 час на изучение темы №1 «Строение атома»;
уменьшено на 2 часа изучение темы №3 «Строение вещества» т.к. виды орбиталей изучены в теме №2 и их перекрывание можно рассмотреть за сокращённое время;
увеличено число часов на 2 часа – темы №7 «Химические реакции» (включение в тему практической работы из практикума);
3) Количество практических работ увеличено до 15 , ввиду наличия оборудования и их важной практической значимости а профильном классе.
Домашние задания приведены с ссылками на соответствующие параграфы и номера вопросов и заданий по учебнику «Химия. 10» авторов О.С. Габриеляна, Ф.Н. Маскаева, С.Ю. Пономарева, В.И. Теренина по ред. В.И. Теренина (М.: Дрофа, 2002).
Данная рабочая программа может быть реализована при использовании традиционной технологии обучения, а также элементов других современных образовательных технологий, передовых форм и методов обучения, таких как проблемный метод, развивающее обучение, компьютерные технологии, тестовый контроль знаний и др.
Контроль уровня знаний учащихся предусматривает: проведение лабораторных, практических, самостоятельных, тестовых и контрольных работ.
В поурочном планировании курсивом выделен материал, который подлежит изучению, но не включается в требования к уровню подготовки выпускников.
УЧЕБНО-МЕТОДИЧЕСКИЙ КОМПЛЕКС
1) Габриелян О.С. Программа курса химии для 8-11 классов общеобразовательных учреждений. – М.6 Дрофа, 2005.
2) Габриелян О.С., Лысова Г.Г. Химия 11 класс. Учебник для общеобразовательных учреждений. М.: Дрофа, 2002.
3) Габриелян О.С., Лысова Г.Г. Химия 11 класс. Профильный уровень. Учебник для общеобразовательных учреждений. – М.: Дрофа, 2006
4) Габриелян О.С., Лысова Г.Г., Введенская А.Г. настольная книга учителя 11 класс/ в двух частях/ Учебно-методическое пособие. - М.: Дрофа, 2004.
5) Габриелян О.С., Березкин П.Н., Ушакова А.А. и др. Химия 11 класс: контрольные и проверочные работы к учебнику О.С. Габриеляна, Г.Г. Лысовой. Химия 11 класс. – М.: Дрофа, 2004
6) Габриелян О.С. Остроумов И.Г. Химия для школьников старших классов и поступающих в ВУЗы. Учебное пособие, -М.: Дрофа, 2005.
7) Габриелян О.С., Лысова Г.Г. Химия 11 класс. Методическое пособие. – М.: Дрофа, 2003.
8) Габриелян О.С., Решетов П.В., Остроумов И.Г., Никитюк А.М. Готовимся к единому государственному экзамену,- М.: Дрофа, 2004.
ДОПОЛНИТЕЛЬНАЯ ЛИТЕРАТУРА
Для учителя:
1) Любимова Н.Б. Вопросы и задачи по общей и неорганической химии. – М.: Высшая школа, 1990.
2) Тулина Н.И. Химия. Практикум по общей химии. 10-11 класс. Профильное образование. – Волгоград: Учитель, 2006
3) Игнатьева С.Ю. Химия. Нетрадиционные уроки 8-11 класс.- Волгоград: Учитель, 2004.
4) Органическая химия. Электронный учебник: Соловов, Дерябина. Центр новых информационных технологий (ЦНИТ_СГАУ) при Самарском государственном аэрокосмическом университете cnit@cnit.ssau.ru, solovov@ssau.ru . Кафедра органической химии Самарского госуниверситета dgi@ssu.samara.ru
5) Химия. 10: контрольные и проверочные работы к учебнику Габриеляна «Химия. 10» / Габриелян, Березкин, Ушакова и др. – 3-е изд., стереотип. – М.: Дрофа, 2005.
6) Полезная химия: задачи и истории / Л.Ю. Аликберова, Н.С. Рукк. – 2-е изд., стереотип. – М.: Дрофа, 2006.
7) Книга для чтения по органической химии.
Для ученика:
1) Крицман В.А. Книга для чтения по неорганической химии. – М.: Просвещение, 1984.
2) Оржековский П.А., Богданова Н.Н., Загорский В.В.и др. Единый государственный экзамен. Химия. – М.: Просвещение, 2005.
3) Лидин Г.А., Маргулис В.Б., Потапова Л.Н. Химические задачи с решениями: пособие для школьников и абитуриентов. – М.: Просвещение, 2005.
4) Тулина Н.И. Химия. Практикум по общей химии. 10-11 класс. Профильное образование. – Волгоград: Учитель, 2006
И для учителя и для учеников на сайте «Сайт учителя химии Ким Н.В.» расположено большое количество сборников вариантов ЕГЭ разных лет, тематических сборников и пособий, необходимых для подготовки к ЕГЭ.
РАБОЧАЯ ПРОГРАММА КУРСА ХИМИИ
Допущено Министерством образования и науки Российской Федерации
для профильного изучения химии в XI классе общеобразовательных учреждений (профильный уровень)
Авторы: И. Г. Остроумов, О. С. Габриелян
ОБЩАЯ ХИМИЯ
11 класс
СОДЕРЖАНИЕ КУРСА ОБЩЕЙ ХИМИИ
Введение. Методы научного познания (5 ч)
Понятие «химическое вещество». Взаимосвязь массы и энергии. Законы сохранения массы и энергии. Роль химии в жизни общества. Взаимосвязь химии, физики, математики и биологии Естественнонаучная картина мира. Основные понятия: атом, вещество, молекула, реакция, уравнение.
Тема 1. Строение атома (17 ч)
Атом — сложная частица. Доказательства сложности строения атома: катодные и рентгеновские лучи, фотоэффект, радиоактивность, электролиз.
Планетарная модель атома Резерфорда. Строение атома по Бору. Современные представления о строении атома. Микромир и макромир. Три основополагающие идеи квантовой механики: дискретность или квантование; корпускулярно-волновой дуализм частиц микромира; вероятностный характер законов микромира.
Состав атомного ядра. Нуклоны: протоны и нейтроны. Нуклиды и изотопы. Устойчивость ядер. Радиоактивный распад и ядерные реакции. Уравнения таких реакций на основе общих для квантовой и классической механики законов сохранения энергии, массы, заряда и импульса.
Электронная оболочка атома. Квантово-механические представления о природе электрона. Понятия об электронной орбитали и электронном облаке. Квантовые числа: главное, орбитальное (побочное), магнитное и спиновое. Распределение электронов по энергетическим уровням, подуровням и орбиталям в соответствии с принципом наименьшей энергии, принципом Паули и правилом Хунда. Электронные конфигурации атомов химических элементов. Некоторые аномалии электронного строения атомов хрома, меди, серебра и др., их причины.
Валентные возможности атомов химических элементов как функция числа непарных электронов в их нормальном и возбужденном состояниях. Другие факторы, определяющие валентные возможности атомов: наличие неподеленных электронных пар и свободных орбиталей.
Электронная классификация химических элементов: s-, р-, d-, f-элементы.
Демонстрации. Модели орбиталей различной формы.
Контрольная работа №1 по теме «Строение атома».
Тема 2. Строение вещества (17 ч)
Химическая связь. Единая природа химической связи Металлическая связь и металлическая кристаллическая решетка. Ионная химическая связь и ионная кристаллическая решетка. Ковалентная химическая связь, ее разновидности и механизмы образования. Характеристики ковалентной связи. Насыщаемость, поляризуемость, направленность. Электроотрицательность. Водородная связь. Межмолекулярные взаимодействия. Единая природа химических связей.
Гибридизация орбиталей и геометрия молекул Sp3 – гибридизация у алканов воды, аммиака, алмаза;
Sp2 – гибридизация у соединений бора, алкенов, аренов, диенов и графита;
Sp – гибридизация у соединений бериллия, алкинов и карбина. Геометрия молекул названных веществ
Чистые вещества и смеси.
Теория химического строения соединений (ТСБ) А.М. Бутлерова Предпосылки создания ТСБ. Основные положения ТСБ и современной теории строения. Диалектические основы общности ПЗ Д.И. Менделеева и ТСБ А.М. Бутлерова в становлении, предсказании и развитии химии.
Полимеры органические и неорганические Примеры. Основные понятия химии ВМС. Способы получения полимеров. Реакции полимеризации и поликонденсации. Неорганические полимеры атомного строения (аллотропные модификации углерода, кристаллический кремний и др.) и молекулярного строения (сера пластическая и др.)
Практическая работа №1.Очистка веществ фильтрованием и разделительной воронкой.
Практическая работа №2. Приготовление растворов различных видов концентрации.
Практическая работа №3. Определение концентрации веществ (при решении задач).
Контрольная работа №2 по теме «Строение вещества»
Тема 3. «ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ПРОТЕКАНИЯ ХИМИЧЕСКИХ РЕАКЦИЙ». (20 ч)
Классификация химических реакций в органической и неорганической химии. Понятие о химической реакции, ее отличие от ядерной реакции. Реакции, идущие без изменения качественного состава веществ: аллотропизация и изомеризация. Реакции, идущие с изменением качественного состава веществ: по числу и характеру реагирующих и образующихся веществ (разложение, соединение, замещение, реакции обмена); по изменению степеней окисления элементов (окислительно-восстановительные и не окислительно-восстановительные); по тепловому эффекту (экзо- и эндотермические); по фазе (гомо- и гетерогенные); по направлению (обратимые и необратимые); по использованию катализатора (каталитические и некаталитические); по механизму (радикальные, молекулярные, ионные); по виду энергии, инициирующей реакцию (фотохимические, радиационные, электрохимические, термохимические).
Вероятность протекания химических реакций. Внутренняя энергия, энтальпия. Тепловой эффект химических реакций. Термохимические уравнения. Стандартные энтальпии реакций и образования веществ. Закон Гесса и следствия, вытекающие из него. Энтропия. Энергия Гиббса — критерий направленности химических реакций в закрытых системах.
Скорость химической реакции. Понятие о скорости реакции (р). Скорость гомо- и гетерогенной реакций. Энергия активации.
Факторы, влияющие на скорость химической реакции. Природа реагирующих веществ. Температура (закон Вант-Гоффа). Концентрация (основной закон химической кинетики). Катализаторы и катализ: гомо- и гетерогенный, их механизмы. Ферменты, их сравнение с неорганическими катализаторами. Ингибиторы и каталитические яды. Зависимость скорости реакции от поверхности соприкосновения реагирующих веществ.
Обратимость химических реакций. Химическое равновесие. Понятие о химическом равновесии. Равновесные концентрации. Динамичность химического равновесия. Константа равновесия. Факторы, влияющие на смещение равновесия: концентрация, давление, температура. Принцип Ле Шателье.
Демонстрации.
Превращение красного фосфора в
белый, кислорода в озон. Модели бутана
и изобутана. Получение кислорода из
пероксида водорода и воды, дегидратация
этанола. Цепочка превращений Р
Р2O5
Н3РO4; свойства уксусной
кислоты; реакции, идущие с образованием
осадка, газа и воды; свойства металлов,
окисление альдегида в кислоту и спирта
в альдегид. Реакции горения; реакции
эндотермические на примере реакции
разложения (этанола, калийной селитры,
бихромата аммония) и экзотермические
на примере реакций соединения
(обесцвечивание бромной воды и раствора
перманганата калия этиленом, гашение
извести и др.). Взаимодействие цинка с
растворами соляной и серной кислот при
разных температурах, разных концентрациях
соляной кислоты; разложение пероксида
водорода с помощью оксида марганца(IV),
каталазы сырого мяса и сырого картофеля.
Взаимодействие цинка, поверхность
которого различна (порошок, пыль,
гранулы), с кислотой. Модель кипящего
слоя. Смещение равновесия в системе
Fe3+ + 3CNS–![]() Fe(CNS)3;
омыление жиров, реакции этерификации.
Зависимость степени электролитической
диссоциации уксусной кислоты от
разбавления. Сравнение свойств 0,1 н
растворов серной и сернистой кислот,
муравьиной и уксусной кислот, гидроксидов
лития, натрия и калия.
Fe(CNS)3;
омыление жиров, реакции этерификации.
Зависимость степени электролитической
диссоциации уксусной кислоты от
разбавления. Сравнение свойств 0,1 н
растворов серной и сернистой кислот,
муравьиной и уксусной кислот, гидроксидов
лития, натрия и калия.
Лабораторные опыты. 1. Получение кислорода разложением пероксида водорода и (или) перманганата калия. 2. Реакции, идущие с образованием осадка, газа или воды, для органических и неорганических кислот.
Практическая работа № 4 «Скорость химических реакций. Химическое равновесие»
Контрольная работа № 3. По теме «Закономерности химических реакций»
ТЕМА №4 «РАСТВОРЫ». (22 ч)
Понятие о растворах. Физико-химическая природа растворения и растворов. Взаимодействие растворителя и растворенного вещества. Растворимость веществ. Способы выражения концентрации растворов: массовая доля растворенного вещества (процентная), молярная, моляльная, нормальная. Титр раствора и титрование.
Теория электролитической диссоциации. Механизм диссоциации веществ с различными видами химической связи. Вклад русских ученых в развитие представлений об электролитической диссоциации. Основные положения теории электролитической диссоциации. Степень электролитической диссоциации и факторы ее зависимости. Сильные и средние электролиты. Константа диссоциации.
Диссоциация воды. Ионное произведение воды. Водородный показатель. Среда водных растворов электролитов. Реакции обмена в водных растворах электролитов.
Гидролиз как обменный процесс. Необратимый гидролиз органических и неорганических соединений и его значение в практической деятельности человека.
Обратимый гидролиз солей. Ступенчатый гидролиз. Практическое применение гидролиза.
Гидролиз органических веществ: белков, жиров, углеводов, полинуклеотидов, АТФ и его биологическое и практическое значение. Омыление жиров. Реакция этерификации.
Окислительно-восстановительные реакции. Отличие от реакций ионного обмена. Восстановители и окислители. Окисление и восстановление. Зависимость окислительно-восстановительных свойств атомов и простых веществ от положения образующих их элементов в периодической таблице Д. И. Менделеева. Важнейшие окислители и восстановители. Восстановительные свойства металлов — простых веществ. Окислительные и восстановительные свойства неметаллов — простых веществ. Восстановительные свойства веществ, образованных элементами в низшей (отрицательной) степени окисления. Окислительные свойства веществ, образованных элементами в высшей (положительной) степени окисления. Окислительные и восстановительные свойства веществ, образованных элементами в промежуточных степенях окисления
Демонстрации. Смещение равновесия диссоциации слабых кислот. Индикаторы и изменение их окраски в разных средах. Сернокислый и ферментативный гидролиз углеводов. Гидролиз карбонатов, сульфатов и силикатов щелочных металлов, нитрата свинца(II) или цинка, хлорида аммония.
Лабораторный опыт. Характер диссоциации различных гидроксидов.
Практическая работа № 5 «Решение экспериментальных работ по теме «Гидролиз»
Практическая работа № 6 «Приготовление растворов различных видов концентрации».
Практическая работа № 7 «Расчёт концентрации веществ разными способами».
Контрольная работа № 4. По теме «Растворы»
ТЕМА №5. ВЕЩЕСТВА И ИХ СВОЙСТВ(49 ч)
Классификация неорганических веществ. Простые и сложные вещества. Оксиды, их классификация. Гидроксиды (основания, кислородсодержащие кислоты, амфотерные гидроксиды). Кислоты, их классификация. Основания, их классификация. Соли средние, кислые, оснóвные и комплексные.
Классификация органических веществ. Углеводороды и классификация веществ в зависимости от строения углеродной цепи (алифатические и циклические) и от кратности связей (предельные и непредельные). Гомологический ряд. Производные углеводородов: галогеналканы, спирты, фенолы, альдегиды и кетоны, карбоновые кислоты, простые и сложные эфиры, нитросоединения, амины, аминокислоты.
Металлы. Положение металлов в периодической системе химических элементов Д. И. Менделеева и строение их атомов. Простые вещества — металлы: строение кристаллической решетки и металлическая химическая связь. Аллотропия. Общие физические свойства металлов и их восстановительные свойства: взаимодействие с неметаллами (кислородом, галогенами, серой, азотом, водородом), водой, кислотами, растворами солей, органическими веществами (спиртами, галогеналканами, фенолами, кислотами), щелочами. Оксиды и гидроксиды металлов. Зависимость свойств этих соединений от степеней окисления металлов. Значение металлов в природе и жизни организмов.
Коррозия металлов. Понятие о коррозии. Химическая коррозия. Электрохимическая коррозия. Способы защиты металлов от коррозии.
Общие способы получения металлов. Металлы в природе. Металлургия и ее виды: пиро-, гидро- и электрометаллургия. Электролиз расплавов и растворов соединений металлов и его практическое значение.
Неметаллы. Положение неметаллов в периодической системе, строение их атомов. Электроотрицательность.
Благородные газы. Электронное строение атомов благородных газов и особенности их химических и физических свойств. Соединения благородных газов.
Неметаллы — простые вещества. Атомное и молекулярное строение неметаллов. Аллотропия. Химические свойства неметаллов. Окислительные свойства: взаимодействие с металлами, водородом, менее электроотрицательными неметаллами, некоторыми сложными веществами. Восстановительные свойства неметаллов в реакциях со фтором, кислородом, сложными веществами-окислителями (азотной и серной кислотами и др.).
Водородные соединения неметаллов. Получение этих соединений синтезом и другими способами. Строение молекул и кристаллов этих соединений. Физические свойства. Отношение к воде. Изменение кислотно-оснóвных свойств в периодах и группах.
Обзорное сравнение основных классов углеводородов (алканы, алкены, алкины, арены). Строение, изомерия и номенклатура, наиболее характерные свойства. Отдельные представители, их получение и применение.
Оксиды и ангидриды карбоновых кислот. Несолеобразующие и солеобразующие оксиды. Кислотные оксиды, их свойства. Оснóвные оксиды, их свойства. Амфотерные оксиды, их свойства. Зависимость свойств оксидов металлов от степени окисления металла. Ангидриды карбоновых кислот, их получение и свойства.
Кислоты органические и неорганические. Кислоты в свете теории электролитической диссоциации (ТЭД). Кислоты в свете протолитической теории. Сопряженные кислотно-оснóвные пары. Кислоты Льюиса. Классификация органических и неорганических кислот. Общие свойства кислот: взаимодействие органических и неорганических кислот с металлами, оснóвными и амфотерными оксидами и гидроксидами, солями; образование сложных эфиров. Особенности свойств концентрированной серной и азотной кислот. Особенности свойств уксусной и муравьиной кислот.
Основания органические и неорганические. Основания в свете теории электролитической диссоциации (ТЭД). Основания в свете протолитической теории. Основания Льюиса. Классификация органических и неорганических оснований. Химические свойства щелочей и нерастворимых оснований. Свойства бескислородных оснований: аммиака и аминов. Взаимное влияние атомов в молекуле анилина.
Амфотерные органические и неорганические соединения. Амфотерные основания в свете протолитической теории. Амфотерность оксидов и гидроксидов переходных металлов: взаимодействие с кислотами и щелочами.
Амфотерность кислот: взаимодействие аминокислот со щелочами, кислотами, спиртами, одна с другой (образование полипептидов); образование внутренней соли (биполярного иона).
Соли. Классификация и химические свойства солей. Особенности солей органических и неорганических кислот. Характерные свойства солей органических кислот: реакции декарбоксилирования. Мыла. Жесткость воды и способы ее устранения.
Генетическая связь между классами органических и неорганических соединений. Понятия о генетической связи и генетических рядах в неорганической и органической химии. Генетические ряды металла (на примере кальция и железа), неметалла (на примере серы и кремния), переходного элемента (на примере цинка). Генетические ряды и генетическая связь в органической химии (на примере соединений двухатомного углерода). Единство мира веществ.
Обзор элементов по электронным семействам: s-, p-, d-,f-элементы.
Демонстрации. Коллекция «Классификация неорганических веществ» и образцы представителей классов. Коллекция «Классификация органических веществ» и образцы представителей классов. Модели кристаллических решеток металлов. Коллекция металлов с разными физическими свойствами. Взаимодействие лития, натрия, магния и железа с кислородом; щелочных металлов с водой, спиртами, фенолом; цинка с растворами соляной и серной кислот; натрия с серой; алюминия с иодом; железа с раствором медного купороса; алюминия с раствором едкого натра. Оксиды и гидроксиды хрома. Коррозия металлов в зависимости от условий. Защита металлов от коррозии: образцы нержавеек, защитных покрытий. Коллекция руд. Электролиз растворов солей. Модели кристаллических решеток иода, алмаза, графита. Аллотропия фосфора, серы, кислорода. Взаимодействие водорода с кислородом, сурьмы с хлором, натрия с иодом, хлора с раствором бромида калия, образцы хлорной и сероводородной воды; обесцвечивание бромной воды этиленом или ацетиленом.
Лабораторные опыты. 1. Ознакомление с образцами представителей классов неорганических веществ. 2. Ознакомление с образцами представителей классов органических веществ. 3. Ознакомление с коллекцией руд. 4. Получение и свойства кислорода. 5. Получение и свойства водорода. 6. Получение и свойства углекислого газа.7. Взаимодействие металлов с растворами кислот и солей. 8. Свойства соляной, серной (разбавленной) и уксусной кислот.9. Получение и амфотерные свойства гидроксида алюминия.
Практическая работа № 8 «Решение экспериментальных задач по неорганической химии»
Практическая работа №9 «Решение экспериментальных задач по органической химии»

Практическая работа № 10 «Исследование восстановительных свойств металлов»
Практические работы №№ 11, 12 «Получение, собирание и распознавание газов и изучение их свойств»
Практическая работа № 13 «Сравнение свойств неорганических и органических соединений»
Практические работы №№ 14, 15 «Генетическая связь между классами неорганических и органических веществ»
Тема 6. Химия в жизни общества (6 ч)
Химия и производство. Химическая промышленность и химические технологии. Сырье для химической промышленности. Вода в химической промышленности. Энергия для химического производства. Научные принципы химического производства. Защита окружающей среды и охрана труда на химическом производстве. Основные стадии химического производства. Сравнение производств аммиака и метанола.
Химия в сельском хозяйстве. Химизация сельского хозяйства и ее направления. Растения и почва, почвенный поглощающий комплекс (ППК). Удобрения и их классификация. Химические средства защиты растений. Отрицательные последствия применения пестицидов и борьба с ними. Химизация животноводства.
Химия и экология. Химическое загрязнение окружающей среды. Охрана гидросферы от химического загрязнения. Охрана почвы от химического загрязнения. Охрана атмосферы от химического загрязнения. Охрана флоры и фауны от химического загрязнения. Биотехнология и генная инженерия.
Химия и повседневная жизнь человека. Домашняя аптека. Моющие и чистящие средства. Средства борьбы с бытовыми насекомыми. Средства личной гигиены и косметики. Химия и пища. Маркировка упаковок пищевых и гигиенических продуктов, расшифровка и умение их читать. Экология жилища. Химия и генетика человека.
Демонстрации. Модели производств серной кислоты и аммиака. Коллекции удобрений и пестицидов. Образцы средств бытовой химии и лекарственных препаратов.
Лабораторные опыты. 1. Ознакомление с коллекциями удобрений и пестицидов. 2. Ознакомление с образцами средств бытовой химии и лекарственных препаратов.
Данная программа реализована в учебниках «Органическая химия, 10» (М.: Просвещение, 2003) авторов О. С. Габриеляна, И. Г. Остроумова, А. А. Карцовой и «Общая химия, 11» (М.: Просвещение, 2005) авторов О. С. Габриеляна, И. Г. Остроумова, С. Н. Соловьева, Ф. Н. Маскаева.
ТРЕБОВАНИЯ К УРОВНЮ ПОДГОТОВКИ ВЫПУСКНИКОВ
В результате изучения химии на профильном уровне ученик должен знать/понимать
роль химии в естествознании, ее связь с другими естественными науками, значение в жизни современного общества;
важнейшие химические понятия: вещество, химический элемент, атом, молекула, масса атомов и молекул, ион, радикал, аллотропия, нуклиды и изотопы, атомные s-, p-, d-орбитали, химическая связь, электроотрицательность, валентность, степень окисления, гибридизация орбиталей, пространственное строение молекул, моль, молярная масса, молярный объем, вещества молекулярного и немолекулярного строения, комплексные соединения, дисперсные системы, истинные растворы, электролитическая диссоциация, кислотно-основные реакции в водных растворах, гидролиз, окисление и восстановление, электролиз, скорость химической реакции, механизм реакции, катализ, тепловой эффект реакции, энтальпия, теплота образования, энтропия, химическое равновесие, константа равновесия, углеродный скелет, функциональная группа, гомология, структурная и пространственная изомерия, индуктивный и мезомерный эффекты, электрофил, нуклеофил, основные типы реакций в неорганической и органической химии;
основные законы химии: закон сохранения массы веществ, периодический закон, закон постоянства состава, закон Авогадро, закон Гесса, закон действующих масс в кинетике и термодинамике;
основные теории химии: строения атома, химической связи, электролитической диссоциации, кислот и оснований, строения органических соединений (включая стереохимию), химическую кинетику и химическую термодинамику;
классификацию и номенклатуру неорганических и органических соединений;
природные источники углеводородов и способы их переработки;
вещества и материалы, широко используемые в практике: основные металлы и сплавы, графит, кварц, стекло, цемент, минеральные удобрения, минеральные и органические кислоты, щелочи, аммиак, углеводороды, фенол, анилин, метанол, этанол, этиленгликоль, глицерин, формальдегид, ацетальдегид, ацетон, глюкоза, сахароза, крахмал, клетчатка, аминокислоты, белки, искусственные волокна, каучуки, пластмассы, жиры, мыла и моющие средства;
В результате изучения химии на профильном уровне ученик должен уметь
называть изученные вещества по «тривиальной» и международной номенклатурам;
определять: валентность и степень окисления химических элементов, заряд иона, тип химической связи, пространственное строение молекул, тип кристаллической решетки, характер среды в водных растворах, окислитель и восстановитель, направление смещения равновесия под влиянием различных факторов, изомеры и гомологи, принадлежность веществ к различным классам органических соединений, характер взаимного влияния атомов в молекулах, типы реакций в неорганической и органической химии;
характеризовать: s- , p- и d-элементы по их положению в периодической системе Д.И.Менделеева; общие химические свойства металлов, неметаллов, основных классов неорганических соединений; строение и свойства органических соединений (углеводородов, спиртов, фенолов, альдегидов и кетонов, карбоновых кислот, аминов, аминокислот и углеводов);
объяснять: зависимость свойств химического элемента и образованных им веществ от положения в периодической системе Д.И. Менделеева; зависимость свойств неорганических веществ от их состава и строения; природу и способы образования химической связи; зависимость скорости химической реакции от различных факторов, реакционной способности органических соединений от строения их молекул;
выполнять химический эксперимент по: распознаванию важнейших неорганических и органических веществ; получению конкретных веществ, относящихся к изученным классам соединений;
проводить расчеты по химическим формулам и уравнениям реакций;
осуществлять самостоятельный поиск химической информации с использованием различных источников (справочных, научных и научно-популярных изданий, компьютерных баз данных, ресурсов Интернета); использовать компьютерные технологии для обработки и передачи информации и ее представления в различных формах;
В результате изучения химии на профильном уровне ученик должен использовать приобретенные знания и умения в практической деятельности и повседневной жизни для:
понимания глобальных проблем, стоящих перед человечеством: экологических, энергетических и сырьевых;
объяснения химических явлений, происходящих в природе, быту и на производстве;
экологически грамотного поведения в окружающей среде;
оценки влияния химического загрязнения окружающей среды на организм человека и другие живые организмы;
безопасной работы с веществами в лаборатории, быту и на производстве;
определения возможности протекания химических превращений в различных условиях и оценки их последствий;
распознавания и идентификации важнейших веществ и материалов; оценки качества питьевой воды и отдельных пищевых продуктов;
критической оценки достоверности химической информации, поступающей из различных источников.
ТЕМАТИЧЕСКОЕ ПЛАНИРОВАНИЕ
|
№ темы |
Название темы |
Количество часов на изучение темы |
Из них |
|
|
Практические работы |
Контрольные работы, зачёты, тесты (подготовка к ЕГЭ) |
|||
|
|
Введение |
5 |
- |
- |
|
1 |
Периодический закон и периодическая система химических элементов Д. И. Менделеева. Строение атома. |
17 |
- |
Контрольная работа № 1 «Строение атома» Проверочных тестов - 3 |
|
2 |
Строение вещества |
17 |
3 |
Контрольная работа № 2 «Строение вещества» Проверочных тестов - 3 |
|
3 |
Основные закономерности протекания химических реакций |
20 |
1 |
Контрольная работа № 3 «Закономерности химических реакций» Проверочных тестов - 5 |
|
4 |
Растворы |
22 |
3 |
Контрольная работа № 4 по теме «Растворы» Проверочных тестов - 4 |
|
5 |
Вещества и их свойства |
49 |
8 |
Контрольная работа № 5 по теме «Вещества и их свойства» Зачётов - 2 Проверочных тестов - 4 |
|
6 |
Химия и общество |
6 |
- |
- |
КАЛЕНДАРНО-ТЕМАТИЧЕСКОЕ ПЛАНИРОВАНИЕ
для профильного изучения химии в XI классе общеобразовательных учреждений (профильный уровень)
Авторы: И. Г. Остроумов, О. С. Габриелян
ОБЩАЯ ХИМИЯ
11 класс
|
Дата |
часы |
Тема урока |
Изучаемые вопросы |
Дополнительно к уроку |
Дом. задание |
||||||||||
|
ЕГЭ |
Эксперимент |
ИКТ |
|||||||||||||
|
5 |
Методы научного познания |
|
|
||||||||||||
|
1 нед. сентября |
1 |
Введение в общую химию. Взаимосвязь химии, физики, математики и биологии. |
Роль химии в жизни общества. Взаимосвязь химии, физики, математики и биологии Естественнонаучная картина мира. |
|
|
презентация |
конспект |
||||||||
|
1 нед. сентября |
2 |
Основные понятия химии. |
Основные понятия: атом, вещество, молекула, реакция, уравнение. |
|
|
презентация |
конспект |
||||||||
|
1,2 нед. сентября |
2 |
Основные законы химии. |
Основные законы. |
|
|
презентация |
конспект |
||||||||
|
17 |
ТЕМА №1 «ПЕРИОДИЧЕСКИЙ ЗАКОН И ПЕРИОДИЧЕСКАЯ СИСТЕМА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ Д.И.МЕНДЕЛЕЕВА. СТРОЕНИЕ АТОМА». |
||||||||||||||
|
2 нед. сентября |
1 |
Атом – сложная частица |
Модели строения атома. Ядро и нуклоны. Нуклиды и изотопы. Электрон. Дуализм электрона |
А1, А2 |
|
презентация |
§1, №1-3 |
||||||||
|
2,3 нед. сентября |
3 |
Состояние электронов в атоме |
Электронное облако и орбиталь. Квантовые числа. Форма орбиталей (s, p,d,f ). Энергетические уровни и подуровни. |
А1, А2 |
|
|
§2, №1-3 №4, №5-7 |
||||||||
|
3 нед. сентября |
2 |
Электронные конфигурации атомов химических элементов |
Распределение электронов по орбиталям в соответствии с принципом Паули и правилом Хунда. Электронные конфигурации атомов элементов. Электронная классификация химических элементов (S, p, d, f – семейств)/ |
А1, А2 |
|
презентация |
§3, №1-3 №5-7 |
||||||||
|
3 нед. сентября |
1 |
Электронные конфигурации атомов химических элементов |
Правила заполнения электронных орбиталей и составления электронных и электронно-графических формул. |
А1, А2 |
|
презентация |
§3, в тетради |
||||||||
|
4 нед. сентября |
1 |
Электронные конфигурации атомов химических элементов |
Проверочный тест по изученному материалу. |
|
|
|
§3, в тетради |
||||||||
|
4 нед. сентября |
2 |
Валентные возможности атомов химических элементов |
Валентные электроны. Основное и возбужденное состояния атомов. Сравнение понятий «валентность» и «степень окисления» |
А3 |
|
|
§4, №1-5 |
||||||||
|
4 нед. сентября 1 нед. октября |
2 |
Валентность и валентные возможности. |
Решение упражнений и заданий тестов по теме. |
Из вариантов ЕГЭ |
|
|
§4, в тетради |
||||||||
|
1 нед. октября |
2 |
Периодический закон и периодическая система химических элементов Д.И. Менделеева в свете учения о строении атома |
Предпосылки открытия ПЗ. Накопление факторологического материала, работы предшественников. Открытие Д.И. Менделеевым ПЗ. Современная формулировка ПЗ и современное состояние ПС химических элементов. Периодическое изменение свойств элементов и их соединений. |
ПСХЭ А1,А2, А3 |
|
презентация |
§5, №1-5 |
||||||||
|
1 нед. октября |
1 |
Периодический закон и периодическая система химических элементов периодичность свойств. |
Проверочный тест по изученному материалу. |
Из вариантов ЕГЭ |
|
|
§5, задание на сайте |
||||||||
|
2 нед. октября |
1 |
Обобщение знаний по теме «Строение атома» |
Выполнение упражнений. Подготовка к контрольной работе (тесту). |
|
|
|
задание на сайте |
||||||||
|
2 нед. октября |
1 |
Контрольная работа № 1 «Строение атома» |
Учет и контроль знаний по теме №1. |
|
|
|
|
||||||||
|
17 |
ТЕМА №2. СТРОЕНИЕ ВЕЩЕСТВА |
|
|||||||||||||
|
2 нед. октября |
1 |
Химическая связь. Единая природа химической связи |
Металлическая связь и металлическая кристаллическая решетка. Ионная химическая связь и ионная кристаллическая решетка. |
А4,А5 |
Д. модели кристаллических решеток с различным типом связей |
|
§6, |
||||||||
|
2 нед. октября |
1 |
Химическая связь. |
Ковалентная химическая связь, ее разновидности и механизмы образования. Характеристики ковалентной связи. Насыщаемость, поляризуемость, направленность. |
А4,А5 |
Д. модели кристаллических решеток с различным типом связей |
презентация |
§6, |
||||||||
|
3 нед. октября |
1 |
Химическая связь. |
Электроотрицательность. Водородная связь. Межмолекулярные взаимодействия. Единая природа химических связей. |
А4,А5 |
Д. модели кристаллических решеток с различным типом связей |
презентация |
§6, |
||||||||
|
3 нед. октября |
1 |
Химическая связь. |
Проверочный тест по изученному материалу. |
Из вариантов ЕГЭ |
|
|
§6, |
||||||||
|
3 нед. октября |
2 |
Гибридизация орбиталей и геометрия молекул |
SР3 – гибридизация у алканов воды, аммиака, алмаза; SР2 – гибридизация у соединений бора, алкенов, аренов, диенов и графита; SР – гибридизация у соединений бериллия, алкинов и карбина. Геометрия молекул названных веществ |
В1 |
Д. модели молекул различной геометрии Д. кристаллические решетки алмаза и графита |
презентация |
§7, |
||||||||
|
4 нед. октября |
3 |
Чистые вещества и смеси. |
Разновидность задач на смеси. Общие подходы к решению задач на смеси. Решение задач на смеси. |
С4 |
|
презентация |
§8,задачи на сайте |
||||||||
|
4 нед. октября |
1 |
Практическая работа №1.Очистка веществ фильтрованием и разделительной воронкой. |
|
отчёт |
|||||||||||
|
2 нед. ноября |
2 |
Теория химического строения соединений (ТСБ) А.М. Бутлерова |
Предпосылки создания ТСБ. Основные положения ТСБ и современной теории строения. Диалектические основы общности ПЗ Д.И. Менделеева и ТСБ А.М. Бутлерова в становлении, предсказании и развитии химии. |
А15, А16 |
|
презентация |
§9. сообщения |
||||||||
|
3 нед. ноября |
2 |
Полимеры органические и неорганические |
Примеры. Основные понятия химии ВМС. Способы получения полимеров. Реакции полимеризации и поликонденсации. Неорганические полимеры атомного строения (аллотропные модификации углерода, кристаллический кремний и др.) и молекулярного строения (сера пластическая и др.) |
|
Д. Коллекции пластмасс и волокон Д. Образцы неорганических полимеров: серы пластической, фосфора красного, кварца. |
|
§10. |
||||||||
|
3 нед. ноября |
1. |
Решение тестов по теме |
|
|
|
|
отчёт |
||||||||
|
3 нед. ноября |
1 |
Обобщение и систематизация знаний |
|
|
|
|
отчёт |
||||||||
|
4 нед. ноября |
1 |
Контрольная работа №2 по теме «Строение вещества» |
Учет и контроль знаний по теме №2. |
|
|
|
|
||||||||
|
20 |
ТЕМА №3 «ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ПРОТЕКАНИЯ ХИМИЧЕСКИХ РЕАКЦИЙ». |
|
|||||||||||||
|
4 нед. ноября |
2 |
Классификация химических реакций в неорганической химии |
Понятие о химической реакции. Реакции, идущие без изменения качественного состава вещества. Реакции, идущие с изменением состава вещества. Особенности классификации реакций в органической химии |
А14 |
Д. Превращение красного фосфора в белый. Д. Получение кислорода из пероксида водорода и воды. Д. Реакции, идущие с образованием осадка, газа или воды. |
презентация |
§11 |
||||||||
|
4 нед. ноября 1 нед. декабря |
2 |
Классификация химических реакций в органической химии |
Реакции, идущие без изменения качественного состава вещества. Особенности классификации реакций в органической химии. |
А14 В2 |
|
презентация |
§11. |
||||||||
|
1 нед. декабря |
2 |
Классификация реакций в неорганической и органической химии. |
Решение упражнений и заданий тестов. |
Из вариантов ЕГЭ |
|
|
§11. |
||||||||
|
1, 2 нед. декабря |
2 |
Почему идут химические реакции |
Закономерности протекания химических реакций. Тепловой эффект. Термохимические уравнения. Понятия об энтальпии и энтропии. Энергия Гиббса. Закон Гесса и следствия из него |
А28 |
Д. Реакции эндотермические (на примере р. разложения известняка или мела, калийной селитры) и экзотермические (на примере р. соединения: обесцвечивание бромной воды и KMnO4 этиленом). Д. Разложение пероксида водорода с помощью оксида марганца IV, фермента каталазы. |
презентация |
§12. |
||||||||
|
2 нед. декабря |
1 |
Почему идут химические реакции |
Решение задач. Тепловой эффект. Термохимические уравнения. |
Из вариантов ЕГЭ А28 |
|
§12. |
|||||||||
|
2 нед. декабря |
2 |
Скорость химических реакций. Факторы, влияющие на скорость химических реакций |
Понятие о скорости химической реакции (Ʋр), ее зависимость от различных факторов. Скорость гомо- и гетерогенной реакций. Закон действующих масс. Элементарные и сложные реакции. Механизм реакции. Энергия активации. Катализаторы и катализ. |
|
Д. Взаимодействие Zn с HCl и H2SO4 при разных температурах; при разных концентрациях HCl |
презентация |
§13. |
||||||||
|
3 нед. декабря |
2 |
Скорость химических реакций. |
Решение задач и заданий тестов. |
А24 |
|
|
§13 |
||||||||
|
3 нед. декабря |
2 |
Обратимость химических реакций. Химическое равновесие. |
Понятие о химическом равновесии, константа равновесия. Смещение равновесия под действием различных факторов. Принцип Ле Шателье |
А25 |
Д. Смещение равновесия в системе Fe3+ + 3 CNS - = Fe (CNS)3 |
|
§14 |
||||||||
|
3 нед. декабря |
1 |
Химическое равновесие. |
Решение задач и заданий тестов.. |
|
|
|
§14 |
||||||||
|
4 нед. декабря |
1 |
Практическая работа № 2«Скорость химических реакций. Химическое равновесие» |
|
|
|
||||||||||
|
4 нед. декабря |
1 |
Окислительно-восстановительные реакции. |
Окислитель. Восстановитель. Типичные окислители и восстановители. Предсказание ОВ свойств. |
А22, А23, С1 |
|
презентация |
конспект |
||||||||
|
4 нед. декабря |
1 |
Окислительно-восстановительные реакции. |
Решение упражнений по теме. |
Из вариантов ЕГЭ |
|
|
Конспект Задание на сайте |
||||||||
|
4 нед. декабря |
1 |
Контрольная работа № 3. По теме «Закономерности химических реакций» |
Контроль и учёт знаний. |
|
|
|
|
||||||||
|
22 |
ТЕМА №4 «РАСТВОРЫ». |
||||||||||||||
|
11.01 14.01 |
2 |
Способы выражения концентрации растворов. |
Тепловые явления при растворении. Способы выражения концентрации растворов: массовая доля растворенного вещества, молярная и моляльная концентрации. Решение упражнений и задач из вариантов ЕГЭ |
А20, А21 |
Д. Растворение окрашенных веществ в воде (сульфата меди II), перманганата калия, хлорида железа III |
презентация |
конспект |
||||||||
|
16.01 16.01 |
2 |
Дисперсные системы. |
Классификация дисперсных систем в зависимости от агрегатного состояния дисперсионной среды и дисперсной фазы, а также по размеру их частиц. Грубодисперсные системы: эмульсии и суспензии. Тонкодисперсные системы: коллоидные (золи и гели) и истинные (молекулярные, молекулярно-ионные и ионные). Эффект Тиндаля. Коагуляция в коллоидных растворах. Синерезис в гелях. |
|
Образцы смесей и дисперсных систем. |
презентация |
|
||||||||
|
18.01 21.01 |
2 |
Растворы и растворимость. |
Физико-химическая природа растворения и растворов. Взаимодействие растворителя и растворенного вещества. Растворимость веществ. Титр раствора и титрование. |
А20, А21 |
|
|
|
||||||||
|
23.01 |
1 |
Практическая работа №3. Определение концентрации веществ (при решении задач). |
|
||||||||||||
|
23.01 |
1 |
Практическая работа №4. Приготовление растворов различных видов концентрации. |
|
§8 |
|||||||||||
|
25.01 |
1 |
Электролитическая диссоциация (ЭД) |
Электролиты и неэлектролиты. ЭД. Сильные и слабые электролиты. Механизм диссоциации веществ с различным типом химической связи. Свойства ионов. Катионы и анионы. |
А19 В3 |
Д. Зависимость степени электролитической диссоциации уксусной кислоты от разбавления. |
презентация |
§15 |
||||||||
|
28.01 30.01 |
2 |
Электролитическая диссоциация (ЭД) |
Кислоты, соли и основания в свете представлений об ЭД. Степень электролитической диссоциации. Константа диссоциации. Произведение растворимости. Свойства растворов электролитов. |
А6, |
Д. Сравнение свойств в 0,1 Н растворов H2SO4 и H2SO3; LiOH, NaOH и KOH Л. Проведение реакций ионного обмена для характеристики св-в электролитов |
презентация |
§15 Сообщение о рН |
||||||||
|
30.01 1.02 |
2 |
Водородный показатель |
Диссоциация воды. Константа диссоциация воды. Ионное произведение воды. Водородный показатель pH. Среды водных растворов электролитов. Значение водородного показателя для химических и биологических процессов. |
А14 В2 |
Л. Использование индикаторной бумаги для определения pH слюны, желудочного сока и др. соков организма человека Л: Определение характера среды раствора с помощью универсального индикатора |
презентация |
§15 |
||||||||
|
|
2 |
Гидролиз |
Понятие «Гидролиз». Гидролиз органических и неорганических соединений. Гидролиз солей – три случая. Ступенчатый гидролиз. Необратимый гидролиз. Значение гидролиза в биологических обменных процессах. Применение гидролиза в промышленности |
А14 В2 |
Д. Сернокислый и ферментативный гидролиз углеводов Л. Разные случаи гидролиза солей. |
презентация |
§16 |
||||||||
|
|
1 |
Гидролиз |
Проверочный тест по изученному материалу. |
Из вариантов ЕГЭ |
|
|
§16 |
||||||||
|
|
1 |
Практическая работа № 5 Экспериментальное определение рН растворов |
Отчёт |
||||||||||||
|
|
1 |
Практическая работа № 6 «Решение экспериментальных задач по теме «Гидролиз» в неорганических веществах» |
Отчёт |
||||||||||||
|
|
1 |
Практическая работа № 7 «Решение экспериментальных задач по теме «Гидролиз» в органических веществах» |
Отчёт |
||||||||||||
|
|
1 |
Обобщение и систематизация знаний по теме «Растворы» |
Решение задач и упражнений. Подготовка к контрольной работе (тесту) |
Из вариантов ЕГЭ |
|
|
|
||||||||
|
|
1 |
Контрольная работа № 4 по теме «Растворы» |
Учет и контроль знаний по теме №4. |
|
|
|
|
||||||||
|
49 |
ТЕМА №5. ВЕЩЕСТВА И ИХ СВОЙСТВА |
|
|||||||||||||
|
|
2 |
Классификация неорганических веществ. |
Простые и сложные вещества. Оксиды, их классификация. Гидроксиды (основания, кислородсодержащие кислоты, амфотерные гидроксиды). Кислоты, их классификация. Основания, их классификация. Соли средние, кислые, основные и комплексные. |
А7, А8, А9, А10 |
Д. Коллекция «Классификация неорганических веществ» и образцы представителей классов Л. Ознакомление с образцами представителей разных классов неорганических веществ |
презентация |
§17 |
||||||||
|
|
1 |
Номенклатура неорганических веществ. |
Основы номенклатуры. Понятия о суффиксах и приставках в названиях. |
А7, А8, А9, А10 |
|
презентация |
конспект |
||||||||
|
|
1 |
Номенклатура неорганических веществ. |
Решение упражнений. Составление названий по формулам Составление формул по названиям. |
Из вариантов ЕГЭ |
|
|
Задания на сайте |
||||||||
|
|
1 |
Практическая работа № 8 «Решение экспериментальных задач по неорганической химии» |
|
|
|||||||||||
|
|
2 |
Классификация органических веществ. |
Углеводороды и классификация веществ в зависимости от строения углеродной цепи и от кратности связи. Гомологический ряд. Производные углеводородов: галогеналканы, спирты, фенолы, альдегиды и кетоны, карбоновые кислоты, простые и сложные эфиры, амины, аминокислоты, нитросоединения. |
А15, А16 |
Д. Коллекция «Классификация органических веществ» и образцы представителей классов. Л.Ознакомление с образцами представителей разных классов органических веществ |
презентация |
§17 |
||||||||
|
|
1 |
Классификация органических веществ. |
Правила номенклатуры. |
А15, А16 |
|
презентация |
§17 |
||||||||
|
|
1 |
Классификация органических веществ. |
Решение упражнений. |
Из вариантов ЕГЭ |
|
|
Задания на сайте |
||||||||
|
|
1 |
Практическая работа №9 «Решение экспериментальных задач по органической химии» |
|
||||||||||||
|
|
2 |
Металлы |
Положение металлов в ПС и строение их атомов. Простые вещества – металлы; строение кристаллов и металлическая химическая связь. Аллотропия. Общие физические свойства металлов. Ряд стандартных электродных потенциалов. Общие химические свойства металлов (восстановительные свойства): взаимодействие с неметаллами водой, кислотой и солями в растворах, органическими веществами, со щелочами. Значение металлов в природе и жизни организмов |
А7 |
Д. 1. Образцы металлов 2. Модели кристаллических решеток металлов 3. Взаимодействие А) Mg и Fe с кислородом Б) щелочных металлов с H2O В) Zn с растоворами HCl и H2SO4 Г) Fe с раствором CuSO4 Д) Al с раствором NaOH |
презентация |
§18 |
||||||||
|
|
2 |
Коррозия металлов и защита от коррозии. |
Понятие «коррозия» Химическая коррозия. Электрохимическая коррозия. Способы защиты металлов от коррозии |
|
Д. 1) Коррозия металлов в зависимости от условий 2) Защита металлов от коррозии: образцы «нержавеек», «защитных покрытий» |
|
§18 Подготовка сообщений |
||||||||
|
|
1 |
Общие способы получения металлов |
Металлы в природе. Металлургия и ее виды: пиро-гидро-электрометаллургия. |
В3 |
Д. Коллекция руд Л. Ознакомление с коллекцией руд |
|
§18 |
||||||||
|
|
2 |
Электролиз |
Электролиз расплавов и растворов соединений металлов и его практическое значение |
В3 |
Д. Электролиз растворов солей |
|
|
||||||||
|
|
1 |
Переходные металлы |
Железо, медь, серебро; цинк, ртуть; хром, марганец. Нахождение в природе; получение и применение простых веществ; свойства простых веществ; важнейшие соединения |
В3 |
Д. Оксиды и гидроксиды хрома. Переход хромата в бихромат и обратно |
|
§18 |
||||||||
|
|
1 |
Урок-упражнение по теме «Металлы» |
Решение задач и упражнений Зачет |
Из вариантов ЕГЭ |
|
|
§18 |
||||||||
|
|
1 |
Практическая работа № 10 «Исследование восстановительных свойств металлов» |
|
|
|||||||||||
|
|
1 |
Неметаллы. Строение атомов, физические свойства |
Положение неметаллов в ПС Д.И. Менделеева, строение их атомов. ЭО. Инертные газы. Двойственное положение водорода в ПС. Неметаллы – простые вещества. Их атомное и молекулярное строение. Аллотропия и ее причины. |
А8 |
Д: Модели кристаллических решеток йода, алмаза, графита. Д: Аллотропия фосфора, серы, кислорода |
презентация |
§19 Подготовка сообщений |
||||||||
|
|
2 |
Химические свойства неметаллов |
Окислительно-восстановительные свойства неметаллов. Взаимодействие неметаллов с металлами, водой, неметаллами, щелочами, солями. Особые свойства галогенов. |
С1 |
Д: Взаимодействие а) H 2 иO 2 б) Na с I2 в) Cl с раствором KBr г) обесцвечивание бромной воды этиленом |
презентация |
§19 |
||||||||
|
|
1 |
Водородные соединения неметаллов |
Получение их синтезом и косвенно. Строение молекул и кристаллов этих соединений. Физические свойства. Отношение к воде. Изменение кислотно-основных свойств в периодах и группах. |
С1 |
Д: Получение и свойства HCl; NH3 |
|
§19 |
||||||||
|
|
2 |
Кислородсодержащие соединения неметаллов |
Несолеобразующие и солеобразующие оксиды. Кислородные кислоты. Изменение кислотных свойств высших оксидов и гидроксидов неметаллов в периодах и группах. Зависимость свойств кислот от степени окисления неметалла |
А8 |
Д: Превращения P – P2O5 –H3PO4 – Ca3 (PO4) |
|
§19 |
||||||||
|
|
1 |
Урок-упражнение по теме «Неметаллы» |
Решение задач и упражнений. Комбинированный зачет |
Из вариантов ЕГЭ |
|
|
§19 на сайте |
||||||||
|
|
2 |
Практические работы №№ 11, 12 «Получение, собирание и распознавание газов и изучение их свойств» |
|
||||||||||||
|
|
3 |
Кислоты органические и неорганические |
1.Кислоты в свете протолитической теории. Сопряженные кислотно-основные пары. 2.Классификация органических и неорганических кислот. Общие свойства кислот. 3.Особенности свойств концентрированной серной и азотной кислот. Особенности свойств уксусной и муравьиной кислот |
А9, С1 |
Д.1) Свойства HCl, разбавленной H2SO4, CH3COOH 2) Взаимодействие концентрированной H2SO4 концентрированной HNO3 и разбавленной HNO3 с Cu 3) Реакция «серебряного зеркала» для HCOOH Л: Свойства HCl, H2SO4 разбавленной; CH3COOH |
презентация |
§20 |
||||||||
|
|
3 |
Основания органические и неорганические |
1.Основания в свете протолитической теории. Классификация органических и неорганических оснований. 2.Химические свойства щелочей и нерастворимых оснований. 3.Свойства бескислородных оснований: аммиака и аминов. Взаимное влияние атомов в молекуле анилина. |
А10, С1 |
Д. 1) Взаимодействие раствора NaOH с CO2 ; Zn (OH)2 2) Взаимодействие NH3 с HCl и H2O; CH3 – NH2 с HCl и H2O Л. Взаимодействие NaOH с солями, CuSO4 и NH4Cl Л. Разложение гидроксида меди (II) |
презентация |
§21 |
||||||||
|
|
2 |
Органические и неорганические амфотерные соединения |
1.Амфотерные соединения в свете протолитической теории. Амфотерность оксидов и гидроксидов некоторых металлов: взаимодействие с кислотами и щелочами. 2.Амфотерность аминокислот |
А11 |
Д.Взаимодействие аминокислот с кислотами и щелочами Л. Получение гидроксида алюминия и изучение его амфотерных свойств |
презентация |
§22 |
||||||||
|
|
1 |
Комплексные соединения. |
Понятие о комплексных соединениях. Комплексообразователь, лиганды, координационное число, внутренняя сфера, внешняя сфера. |
|
|
презентация |
конспект |
||||||||
|
|
1 |
Практическая работа № 13 «Сравнение свойств неорганических и органических соединений» |
|||||||||||||
|
|
3 |
Генетическая связь между классами органических и неорганических соединений |
1.Понятие о генетической связи и генетических рядах в неорганической и органической химии. Генетические ряды металла (на примере Ca и Fe). 2.Генетические ряды неметалла (на примере S и Si), переходного элемента (на примере Zn). 3. Генетические ряды и генетическая связь в органической химии. Единство мира веществ. |
А14 |
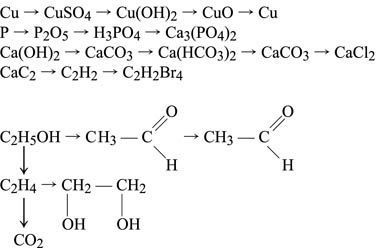
Д. Осуществление переходов: Ca – CaO – Ca(OH)2 Cu – CuO – CuSO4 – Cu(OH)2 – CuO – Cu C2H5OH – C2H4 – C2H4Br2 |
|
§23 |
||||||||
|
|
1 |
Генетическая связь между классами органических соединений |
Решение цепочек превращений. |
А14 |
Из вариантов ЕГЭ |
|
§23 на сайте |
||||||||
|
|
1 |
Генетическая связь между классами неорганических соединений |
Решение цепочек превращений. |
А14 |
Из вариантов ЕГЭ |
|
§23 На сайте |
||||||||
|
|
2 |
Практические работы №№ 14 «Генетическая связь между классами неорганических веществ» Практические работы №№ 15 «Генетическая связь между классами органических веществ» |
|
|
Практические работы №№ 14, 15 «Генетическая связь между классами неорганических и органических веществ» |
||||||||||
|
|
2 |
Обобщение и систематизация знаний по теме «Вещества и их свойства» |
Решение задач и упражнений по теме; подготовка к контрольной работе |
|
|
|
|
||||||||
|
|
1 |
Контрольная работа № 5 по теме «Вещества и их свойства» |
Контроль и учёт знаний |
|
|
Подготовка рефератов |
|||||||||
|
2 |
ТЕМА №6. ХИМИЯ И ОБЩЕСТВО (семинары) |
|
|
|
ТЕМА №6. ХИМИЯ И ОБЩЕСТВО |
||||||||||
|
|
1 |
Химия и производство Химия и сельское хозяйство |
семинарские занятия по плану:
|
А27 |
Д. Модели производства серной кислоты и аммиака Л. Ознакомление с коллекцией удобрений и пестицидов |
презентация |
§24 Подготовка сообщений §25 |
||||||||
|
|
1 |
Химия и экология Химия и повседневная жизнь человека |
семинарские занятия по плану:
6. биотехнология и генная инженерия
химия и гигиена человека |
|
|
презентация |
§26 Подготовка сообщений |
||||||||
|
|
|
|
|
|
|
|
|
||||||||
- Международный вебинар «Волонтёрство и новые воспитательные практики в школе»
- Международный вебинар «Обучение грамоте старших дошкольников с помощью развивающих игр В. В. Воскобовича: практика реализации ФГОС и ФОП ДО»
- Вебинар «Социально-коммуникативное развитие детей дошкольного возраста в условиях реализации ФОП ДО и обновлённого ФГОС ДО»
- Международный вебинар «Цель и преимущества использования ТРИЗ-технологии в дошкольном образовании в условиях реализации ФОП ДО»
- Психология профессионального образования: общая характеристика
- Вебинар «Кинезиологические игры и упражнения в развитии психических процессов дошкольников»