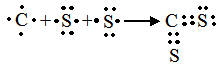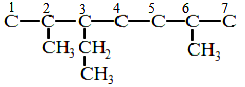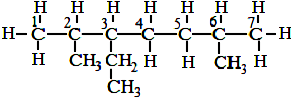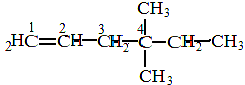Муниципальное казённое общеобразовательное учреждение
« Средняя общеобразовательная школа №4 »


(ПАМЯТКИ И АЛГОРИТМЫ
по развитию общеучебных и
специальных умений и
навыков учащихся по химии).
Кирейто Наталья Михайловна
Учитель химии.
Первая квалификационная категория
г. Исилькуль
2012 год
Перечень памяток по развитию специальных и
общеучебных умений по химии
1.ОЗНАКОМЛЕНИЕ СО СТРУКТУРОЙ УЧЕБНИКА, ЕГО
МЕТОДИЧЕСКИМ АППАРАТОМ……………………… 6
2. КАК ПОЛЬЗОВАТЬСЯ ИЛЛЮСТРАЦИЯМИ УЧЕБНИКА В КАЧЕСТВЕ ИСТОЧНИКА ЗНАНИЙ …………………… . 7
3.КАК ВЫДЕЛЯТЬ ГЛАВНОЕ В ТЕКСТЕ УЧЕБНИКА ….. 8
4. ТРЕБОВАНИЯ К РЕЧИ ШКОЛЬНИКА …………… ….. 8
5. КАК ПЕРЕСКАЗАТЬ ТЕКСТ УЧЕБНИКА ДРУГИМИ
СЛОВАМИ ………………………… .. 9
6. КАК ПРОВОДИТЬ СРАВНЕНИЕ ………………………. 9
7. КАК СДЕЛАТЬ ВЫВОД, ОБОБЩАЮЩИЙ ИЗУЧЕННЫЕ
ФАКТЫ ………………… ……... 10
8. КАК СОСТАВИТЬ ПРОСТОЙ ПЛАН СТАТЬ ………. 10
9. КАК СОСТАВИТЬ СЛОЖНЫЙ ПЛАН СТАТЬИ ……... 11
10. КАК СОСТАВИТЬ ПЛАН-КОНСПЕКТ …… ………….. 11
11. КАК РАБОТАТЬ С УЧЕБНИКОМ ДОМ ……………….. 12
12. ПЛАН ИЗЛОЖЕНИЯ ЗАКОНА …………………………. 12
13. ПЛАН ИЗЛОЖЕНИЯ ТЕОРИИ……………………………. 12
14. ПЛАН ИЗЛОЖЕНИЯ ТЕОРЕТИЧЕСКИХ ПОНЯТИЙ … 13
15. ПЛАН ОПИСАНИЯ ЭЛЕМЕНТА ДО ИЗУЧЕНИЯ ТЕМЫ «ПЕРИОДИЧЕСКИЙ ЗАКОН И ПЕРИОДИЧЕСКАЯ СИСТЕМА Д.И.МЕНДЕЛЕЕВА. СТРОЕНИЕ АТОМА»……… …13
16. ПЛАН ОПИСАНИЯ ПРОСТОГО ВЕЩЕСТВА ДО ИЗУЧЕНИЯ ТЕМЫ «ПЕРИОДИЧЕСКИЙ ЗАКОН И ПЕРИОДИЧЕСКАЯ СИСТЕМА Д.И.МЕНДЕЛЕЕВА. СТРОЕНИЕ АТОМА» …… ….. 14
17. ПЛАН ОПИСАНИЯ ЭЛЕМЕНТА ПОСЛЕ ИЗУЧЕНИЯ ТЕМЫ «ПЕРИОДИЧЕСКИЙ ЗАКОН И ПЕРИОДИЧЕСКАЯ СИСТЕМА Д.И.МЕНДЕЛЕЕВА. СТРОЕНИЕ АТОМА» ……………….… 14
18. ПЛАН ОПИСАНИЯ ПРОСТОГО ВЕЩЕСТВА ПОСЛЕ ИЗУЧЕНИЯ ТЕМЫ «ПЕРИОДИЧЕСКИЙ ЗАКОН И ПЕРИОДИЧЕСКАЯ СИСТЕМА Д.И.МЕНДЕЛЕЕВА. СТРОЕНИЕ АТОМА» ……………………14
19. . ПЛАН ОПИСАНИЯ СЛОЖНОГО ВЕЩЕСТВА ПОСЛЕ ИЗУЧЕНИЯ ТЕМЫ «ПЕРИОДИЧЕСКИЙ ЗАКОН И ПЕРИОДИЧЕСКАЯ СИСТЕМА Д.И.МЕНДЕЛЕЕВА. СТРОЕНИЕ АТОМА» ……………………15
20. ПЛАН ОПИСАНИЯ ГРУППЫ (ГЛАВНОЙ ПОДГРУППЫ) ЭЛЕМЕНТОВ ПОСЛЕ ИЗУЧЕНИЯ ТЕМЫ «ПЕРИОДИЧЕСКИЙ ЗАКОН И ПЕРИОДИЧЕСКАЯ СИСТЕМА Д.И.МЕНДЕЛЕЕВА. СТРОЕНИЕ АТОМА» …………………………………… 15
21. ПЛАН ИЗЛОЖЕНИЯ ПРОИЗВОДСТВЕННЫХ ПРОЦЕССОВ.
22. КАК РЕШАТЬ ЗАДАЧИ РАСЧЁТНОГО ХАРАКТЕРА (ИЛИ
ВЫПОЛНЯТЬ УПРАЖНЕНИЯ), ДАННЫЕ В КОНЦЕ
ПАРАГРАФА ……………………………………….……….. 16
23. КАК РКШАТЬ ЗАДАЧИ ЭКСПЕРИМЕНТАЛЬНОГО
ХАРАКТЕРА …………………………….. 17
24. КАК ПОЛЬЗОВАТЬСЯ ИНСТРУКЦИЯМИ ПО ВЫПОЛНЕНИЮ
ЛАБОРАТОРНЫХ ОПЫТОВ И ПРАКТИЧЕСКИХ
РАБОТ ………………………………………………..…………. 17
25. КАК СОСТАВИТЬ УРАВНЕНИЕ ХИМИЧЕСКОЙ
РЕАКЦИИ ……………...……………… ……. 18
26. КАК СОСТАВИТЬ ФОРМУЛУ БИНАРНОГО
СОЕДИНЕНИЯ …………………………………… 18
27. КАК ОПРЕДЕЛИТЬ СТЕПЕНЬ ОКИСЛЕНИЯ ПО
ФОРМУЛЕ ……………………………...…… 19
28. КАК СОСТАВИТЬ МОЛЕКУЛЯРНУЮ ФОРМУЛУ ВЕЩЕСТВА, ИСПОЛЬЗУЯ ПОНЯТИЕ СТЕПЕНИ ОКИСЛЕНИЯ …………… 20
29. КАК НАПИСАТЬ ХИМИЧЕСКУЮ (ЭМПИРИЧЕСКУЮ) ФОРМУЛУ
СОЕДИНЕНИЯ ПО ЕГО НАЗВАНИЮ ……………………… 25
30. КАК СОСТАВИТЬ ЭЛЕКТРОННУЮ И СТРУКТУРНУЮ ФОРМУЛЫ
ВЕЩЕСТВ ……………………………………………………… 26
31. КАК СОСТАВИТЬ УРАВНЕНИЕ ОКИСЛИТЕЛЬНО-
ВОССТАНОВИТЕЛЬНОЙ РЕАКЦИИ СО СХЕМОЙ
ЭЛЕКТРОННОГО БАЛАНСА ……………………….………… 27
32. КАК СОСТАВИТЬ ЭЛЕКТРОННУЮ ФОРМУЛУ ОБРАЗОВАНИЯ
ВЕЩЕСТВА ………….………………………………………… 28
33. КАК СОСТАВИТЬ УРАВНЕНИЕ РЕАКЦИИ ИОННОГО ОБМЕНА
МЕЖДУ РАСТВОРАМИ ЭЛЕКТРОЛИТОВ ………………… 29
34. КАК СОСТАВИТЬ ХИМИЧЕСКОЕ УРАВНЕНИЕ РЕАКЦИИ
ИСХОДЯ ИЗ СОКРАЩЁННОГО ИОННОГО УРАВНЕНИЯ ..30
35. КАК СОСТАВИТЬ УРАВНЕНИЕ РЕАКЦИИ ГИДРОЛИЗА
СОЛЕЙ ……………………………………………………………. 31
36. КАК НАЗВАТЬ ПРЕДЕЛЬНЫЕ УГЛЕВОДОРОДЫ С
РАЗВЕТВЛЁННЫМ СТРОЕНИЕМ ПО МЕЖДУНАРОДНОЙ
НОМЕНКЛАТУРЕ ………………………………………..………32
37. КАК СОСТАВИТЬ СТРУКТУРНУЮ ФОРМУЛУ ПРЕДЕЛЬНОГО
УГЛЕВОДОРОДА НЕРАЗВЕТВЛЁННОГО СТРОЕНИЯ ПО ЕГО
НАЗВАНИЮ …………………………………………. …………..34
38. КАК СОСТАВИТЬ СТРУКТУРНУЮ ФОРМУЛУ ВЕЩЕСТВА
РАЗВЕТВЛЁННОГО СТРОЕНИЯ ПО ЕГО
НАЗВАНИЮ……………………………………………………… 36
39. КАК СОСТАВИТЬ СТРУКТУРНУЮ ФОРМУЛУ ВЕЩЕСТВА ПО
ЕГО НАЗВАНИЮ ПОСЛЕ ИЗУЧЕНИЯ РАЗЛИЧНЫХ КЛАССОВ
ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ ……………………………. 37
40. ПАМЯТКА ПО ОЦЕНКЕ И САМООЦЕНКЕ
ОБУЧАЮЩЕГОСЯ ……………………………………………….. 38
41. ЛИСТ ОЦЕНКИ И САМООЦЕНКИ ОБУЧАЮЩЕГОСЯ ……. 41
42. КРИТЕРИИ ОЦЕНКИ ПРОЕКТНОЙ ИССЛЕДОВАТЕЛЬСКОЙ
РАБОТЫ ……………………………………………………….… . 42
43.. КАК СОСТАВИТЬ РЕЦУНЗИЮ НА РАБОТУ (ОТВЕТ)
ОБУЧАЮЩЕГОСЯ ………………………………………………. 42
« Поставь над собой сто учителей – все они окажутся
бессильными, если ты не можешь сам себя заставить и сам
требовать от себя».
В.А.Сухомлинский.

1. ОЗНАКОМЛЕНИЕ СО СТРУКТУРОЙ УЧЕБНИКА, ЕГО МЕТОДИЧЕСКИМ АППАРАТОМ.
-
Ознакомьтесь со структурой учебника. Рассмотрите оглавление: какие темы и вопросы предстоит вам изучить. Как пользоваться оглавлением?
-
Рассмотрите, чем заканчиваются каждый параграф, тема, раздел. Как Вы думаете, для чего в конце каждого параграфа даны вопросы и упражнения?
-
Какие условные обозначения приняты в тексте учебника?
-
Как в учебнике выделяются определения понятий, законов?
-
Какие иллюстрации даны в учебнике? С какой целью?
-
Рассмотрите инструкции по выполнению лабораторных опытов и практических работ. Где они расположены? С какой целью авторы учебника их вводят? Для чего в отдельные инструкции включены рисунки, таблицы?
-
Найдите в учебнике страницы, где даны ответы на наиболее трудные вопросы и задачи.
-
Обратите внимание на предметный и именной указатели (10 класс). Для чего они включены в учебник? Как ими пользоваться?
2. КАК ПОЛЬЗОВАТЬСЯ ИЛЛЮСТРАЦИЯМИ УЧЕБНИКА В КАЧЕСТВЕ ИСТОЧНИКА ЗНАНИЙ.
-
Назовите цель применения рисунка, таблицы или схемы при изучении конкретного материала.
-
Вдумайтесь в название иллюстрации. Соответствует ли оно представленному в иллюстрации содержанию? К какой части параграфа относится эта иллюстрация?
-
Рассмотрите внимательно рисунок (таблицу, схему). Что здесь изображено?
-
Найдите в тексте параграфа сведения, факты, подтверждающие или конкретизирующие содержание приведенной иллюстрации.
-
Составьте сами рассказ по рисунку (схеме и т.д.).
-
Сравните два рисунка в учебнике (или две таблицы), иллюстрирующие, например, свойства или применение изученных веществ, отметьте сходства и различие их. На основе систематизации изученного материала составьте таблицу или схему, отражающую классификацию веществ, сравнение физических или химических свойств их, областей применения и т.д.
7. Назовите авторов учебника.
8. Ознакомьтесь со справочными таблицами учебника. Какие сведения представлены в этих таблицах?
3.КАК ВЫДЕЛЯТЬ ГЛАВНОЕ В ТЕКСТЕ УЧЕБНИКА.
1. Внимательно прочитайте параграф или часть его. Выделите главное (основную мысль) в прочитанном тексте.
-
Выделите известные вам понятия. Где вы встречались с ними ранее?
3. Выпишите новые понятия, определения, формулировки. Найдите в тексте примеры, факты, подтверждающие главное (основное) в содержании материала. Придумайте свои примеры, взятые из жизненных наблюдений, подтверждающие главное (например, о свойствах вещества, его применения и т.п.).
4.ТРЕБОВАНИЯ К РЕЧИ ШКОЛЬНИКА.
-
Содержательная – полно, конкретно, четко раскрывать тему.
-
Логичная – последовательно, доказательно, пропорционально раскрывать содержание; выводы должны обосновываться в процессе изложения фактов.
-
Богатая – по форме, по своим синтаксическим конструкциям, по словарному составу, по применяемым языковым средствам (синонимам, образным выражениям и др.).
-
Эмоциональная и выразительная - ярко и образно выражать мысли и чувства говорящего, его оценки явлений, фактов (посредством умелого отбора примеров, эпитетов, точных слов, интонаций).
-
Правильная – соблюдение норм русского литературного языка, чистоты речи – отсутствие слов – паразитов, диалектов и написания химических терминов.
5.КАК ПЕРЕСКАЗАТЬ ТЕКСТ УЧЕБНИКА ДРУГИМИ СЛОВАМИ.
-
Внимательно прочитайте материал параграфа.
-
Найдите в тексте ответы на поставленные вопросы.
-
Составьте ответы на вопросы другими словами.
-
Перескажите содержание параграфа другими словами (кратко, подробно, близко к тексту), используя составленный вами план.
6. КАК ПРОВОДИТЬ СРАВНЕНИЕ.
1. Выделение в однородных явлениях сопоставимых существенных признаков.
2.Расположение этих признаков в определенной последовательности (план сравнения) и, если возможно, по степени важности и зависимости от ведущего признака.
3.Последовательное сравнение обоих объектов, т.е. высказывание суждений о них по каждому из выделенных признаков.
4.В качестве выводов – установление сходства и различия, изменений в развитии явления от одного этапа к другому, оценка.
7.КАК СДЕЛАТЬ ВЫВОД, ОБОБЩАЮЩИЙ ИЗУЧЕННЫЕ ФАКТЫ.
Вспомни наиболее существенное из прочитанного по данному вопросу:
-
Основные факты.
-
Причинно – следственные и другие связи между ними.
-
Оценку: значение этих фактов, их роль в общественном развитии.
-
КАК СОСТАВИТЬ ПРОСТОЙ ПЛАН СТАТЬИ
-
Прочитай статью по абзацам.
-
Найди в ней законченные части, в каждой выдели главное.
-
Озаглавь каждую часть.
-
Проверь свою работу: выражает ли заголовок главное, нет ли повторений в названиях пунктов.
9.КАК СОСТАВИТЬ СЛОЖНЫЙ ПЛАН СТАТЬИ
-
Наметь главные части статьи.
-
Каждую часть озаглавь по главной ведущей мысли. Пронумеруй эти заголовки римскими цифрами.
-
Внутри каждой части укажи мысли (фактов), которые раскрывают главную мысль. Озаглавь их, пронумеруй подпункты плана арабскими цифрами.
-
Не выходи в плане за рамки темы статьи и не сужай ее.
10.КАК СОСТАВИТЬ ПЛАН – КОНСПЕКТ
-
Подготовься к выполнению задачи: раздели развернутый лист тетради на две неравные части – слева будет записываться план, а справа - конспект.
-
Прочти текст целиком.
-
Выдели в нем логически законченные части (помни, что каждая часть не обязательно состоит из одного абзаца).
4. Сформулируй кратко главную мысль каждой части в виде заголовка: выпиши все заголовки (пункты плана) на левой стороне листа (нумеруй их римскими цифрами).
5. В каждой части выдели: факты, цифры, выводы, уточняющие главную мысль. Кратко перескажи их, а если это трудно, процитируй текст источника, заключая его в кавычки. Основные положения конспекта выписывай на правой стороне листа против соответствующих заголовков (нумеруя арабскими цифрами).
6. Проверь сделанную работу. Если нужно, исправь, уточни заголовки.
11. КАК РАБОАТЬ С УЧЕБНИКОМ ДОМА
-
Определите, что в изучаемом параграфе нужно выучить близко к тексту, что уметь пересказывать своими словами.
-
Составьте план устного ответа на вопросы.
3. При выполнении письменного задания вначале еще раз прочтите текст учебника и выделите тот материал, который необходимо использовать.
12. ПЛАН ИЗЛОЖЕНИЯ ЗАКОНА.
-
История открытия.
-
Формулировка.
-
Применение.
-
Значение закона для развития науки и формирования научно – материалистического мировоззрения.
13. ПЛАН ИЗЛОЖЕНИЯ ТЕОРИИ.
1. История возникновения теории.
2. Основные положения теории и их доказательства.
3. Практическое применение теории.
14. ПЛАН ИЗЛОЖЕНИЯ ТЕОРИТИЧЕСКИХ ПОНЯТИЙ.
-
Формулировка определения понятий.
-
Примеры.
15. ПЛАН ОПИСАНИЯ ЭЛЕМЕНТА ДО ИЗУЧЕНИЯ ТЕМЫ «ПЕРИОДИЧЕСКИЙ ЗАКОН И ПЕРИОДИЧЕСКАЯ СИСТЕМА Д.И. МЕНДЕЛЕЕВА. СТРОЕНИЕ ВЕЩЕСТВА».
-
Химический знак.
-
Атомная масса.
16. ПЛАН ОПИСАНИЯ ПРОСТОГО ВЕЩЕСТВА ДО ИЗУЧЕНИЯ ТЕМЫ «ПЕРИОДИЧЕСКИЙ ЗАКОН И ПЕРИОДИЧЕСКАЯ СИСТЕМА Д.И. МЕНДЕЛЕЕВА. СТРОЕНИЕ ВЕЩЕСТВА»
-
Химическая формула.
-
Молекулярная масса.
-
Физические свойства.
-
Способность образовывать аллотропные видоизменения.
-
Химические свойства (отношения к простым и сложным веществам).
-
Применение.
-
Нахождение в природе.
-
Способы получения в лаборатории и промышленности.
17. ПЛАН ОПИСАНИЯ ЭЛЕМЕНТА ПОСЛЕ ИЗУЧЕНИЯ ТЕМЫ «ПЕРИОДИЧЕСКИЙ ЗАКОН И ПЕРИОДИЧЕСКПАЯ СИСТЕМА Д.И. МЕНДЕЛЕЕВА. СТРОЕНИЕ ВЕЩЕСТВА».
-
Химический знак.
-
Атомная масса.
-
Положение элемента в периодической системе (порядковый номер, номер периода, четный или нечетный ряд, номер группы, подгруппа).
-
Строение атома (заряд ядра, состав ядра, число электронных слов и общее число электронов в наружном слое).
-
Состав и характер высшего оксида.
-
Состав и характер гидроксида для элементов главных подгрупп I, II, III групп.
-
Формула водородного соединения для элементов главных подгрупп IV и VII групп.
18. ПЛАН ОПИСАНИЯ ПРОСТОГО ВЕЩЕСТВА ПОСЛЕ ИЗУЧЕНИЯ ТЕМЫ «ПЕРИОДИЧЕСКИЙ ЗАКОН И ПЕРИОДИЧЕСКПАЯ СИСТЕМА Д.И. МЕНДЕЛЕЕВА. СТРОЕНИЕ ВЕЩЕСТВА»
-
Химическая формула, структурная и электронная.
-
Вид химической связи.
-
Место в классификации.
-
Физические свойства.
-
Химические свойства в связи со строением (отношение к простым и сложным веществам).
-
Нахождение в природе.
-
Применение в быту и народном хозяйстве.
-
Получение в лаборатории и технике.
19. ПЛАН ОПИСАНИЯ СЛОЖНОГО ВЕЩЕСТВА ПОСЛЕ ИЗУЧЕНИЯ ТЕМЫ «ПЕРИОДИЧЕСКИЙ ЗАКОН И ПЕРИОДИЧЕСКПАЯ СИСТЕМА Д.И. МЕНДЕЛЕЕВА. СТРОЕНИЕ ВЕЩЕСТВА»
-
Химическая формула.
-
Вид химической связи.
-
Место в классификации.
-
Физические свойства.
-
Химические свойства.
-
Применение.
-
Нахождение в природе.
-
Получение в лаборатории и промышленности.
20. ПЛАН ОПИСАНИЯ ГРУППЫ (ГЛАВНОЙ ПОДГРУППЫ) ЭЛЕМЕНТОВ ПОСЛЕ ИЗУЧЕНИЯ ТЕМЫ «ПЕРИОДИЧЕСКИЙ ЗАКОН И ПЕРИОДИЧЕСКАЯ СИСТЕМА Д.И. МЕНДЕЛЕЕВА. СТРОЕНИЕ ВЕЩЕСТВА»
-
Химические знаки элементов данной группы (главной подгруппы).
-
Положение этих элементов в периодической системе.
-
Атомные массы
-
Сходство и отличие в строении атомов этих элементов.
-
Изучение радиусов атомов с возрастанием порядкового номера данных элементов, электроотрицательность.
-
Состав водородных соединений для элементов главных подгрупп 4-7 групп.
-
Формула и характер высших оксидов этих элементов.
-
Формула и характер высших оксидов для элементов главных подгрупп 1,2 и 3 групп.
21. ПЛАН ИЗЛОЖЕНИЯ ПРОИЗВОДСТВЕННЫХ ПРОЦЕССОВ
-
Химические реакции, лежащие в основе производства, и условия их течения.
-
Сырье, его состав и свойства.
-
Главные стадии производства.
-
Устройства и принципы действия типичных аппаратов.
-
Основные научные принципы производства.
-
Характеристика конечного продукта и его народнохозяйственное значение.
22. КАК РЕШАТЬ ЗАДАЧИ РАСЧЕТНОГО ХАРАКТЕРА (ИЛИ ВЫПОЛНЯТЬ УПРАЖНЕНИЯ), ДАННЫЕ В КОНЦЕ ПАРАГРАФА
-
Прочитайте внимательно текст задачи и подумайте, к какому типу она относится.
-
Выделите данные (известные) величины и искомые.
-
Какой химический закон или понятие лежит в основе решения задачи (упражнения)?
-
Выберите наиболее рациональный путь решения.
-
Составьте план решения задачи.
-
Напишите правильно химическую формулу или уравнение реакции, необходимые для решения задачи (упражнения). Запишите ход решения задачи, выполните вычисления.
-
Запишите полученный ответ.
-
Проверьте правильность решения задачи.
-
Можно ли эту задачу (упражнение) решить другим путем?
23. КАК РЕШАТЬ ЗАДАЧИ ЭКСПЕРИМЕНТАЛЬНОГО ХАРАКТЕРА
-
Внимательно прочтите текст экспериментальной задачи.
-
Выделите основную цель ее решения.
-
Составьте план решения экспериментальной задачи.
-
Подумайте, какие условия необходимы для проведения экспериментальной части исследования.
-
Подберите необходимые химические реактивы.
-
Соберите прибор (если необходимо), в котором предстоит выполнить эксперимент.
-
Сделайте рисунок этого прибора.
-
Проведите самостоятельно опыт, запишите свои наблюдения.
-
Составьте отчет, включающий рисунок прибора, краткое описание проделанных опытов, уравнения химических реакций, выводы.
24. КАК ПОЛЬЗОВАТЬСЯ ИНСТРУКЦИЯМИ ПО ВЫПОЛНЕНИЮ ЛАБОРАТОРНЫХ ОПЫТОВ И ПРАКТИЧЕСКИХ РАБОТ
-
Какова цель предложенной в учебнике инструкции? Вдумайтесь в название инструкции. Описание, какого опыта она включает? К какой теме урока относится этот опыт?
-
Прочитайте внимательно всю инструкцию для выполнения, данного опыта. Все ли вам понятно? Что вызывает затруднения?
-
Продумайте, какова последовательность выполнения отдельных химических операция в предложенном опыте.
-
Рассмотрите иллюстрации (рисунок, таблицу), включенные в инструкцию к данной работе.
-
В соответствие с инструкцией сделайте рисунок прибора, в котором проводится опыт.
-
Точно руководствуясь инструкцией, выполните опыт.
-
Составьте отчет о проделанной работе.
-
Можно ли этот опыт выполнить в другом приборе, другим способом?
25. КАК СОСТАВИТЬ УРАВНЕНИЕ ХИМИЧЕСКОЙ
РЕАКЦИИ
-
Напишите формулы веществ, которые вступают в реакцию.
-
Поставьте одну черточку в сторону продуктов реакции.
-
Напишите формулы веществ, которые образуются после реакции.
-
Проверьте, учитывая валентность, правильно ли составлены формулы всех веществ.
-
Расставьте коэффициенты, если в этом есть необходимость.
-
Поставьте знак равенства в уравнении.
-
Проверьте правильность расставленных коэффициентов.
26. КАК СОСТАВИТЬ ФОРМУЛУ БИНАРНОГО СОЕДИНЕНИЯ
НАПРИМЕР: необходимо составить формулу соединения, состоящего из двух химических элементов фосфора и кислорода.
1. При написании химической формулы существует определенный порядок расстановки знаков химических элементов в формуле. Обычно на первом месте записывают знак элемента – металла, а на втором – знак элемента – неметалла. Если в состав соединения входят два элемента – неметалла, то на второе место ставится фтор, хлор, кислород, азот. Запишите в формуле заданного соединения знак фосфора на первом месте, а знак кислорода – на втором.
2. Над знаками элементов проставьте их валентности (валентность фосфора равна пяти).
3. Найдите наименьшее общее кратное валентностей обоих элементов. Наименьшее общее кратное – это наименьшее число, которое делится без остатка на валентности обоих элементов.
4. Поделите наименьшее общее кратное на валентность фосфора. Вы найдете индекс внизу слева от знака элемента фосфора.
5. Найдите индекс элемента кислорода, поделив наименьшее общее кратное на валентность кислорода. Запишите его.
6. Проверьте правильность составления формулы заданного соединения, перемножив индексы на валентности соответствующих элементов. Формула составлена правильно, если полученные числовые значения для каждого элемента, входящего в состав соединения, равны.
-
Название соединения складывается от латинского названия элемента, знак которого стоит на втором месте, с прибавлением суффикса – ид и русского названия элемента, знак которого стоит на первом вместе.
V II
-
НАПРИМЕР: Р2О5 – оксид фосфора. V · 2 = 10
II · 5 = 10
27. КАК ОПРЕДЕЛИТЬ СТЕПЕНЬ ОКИСЛЕНИЯ ПО ФОРМУЛЕ.
НАПРИМЕР: Определите степень окисления каждого элемента в нитрате натрия.
-
Напишите формулу нитрата натрия - Na NO3.
-
По периодической системе элементов Д.И.Менделеева определите степень окисления натрия и кислорода, т.е. «крайних» элементов. Na и О:
+ -2
Na N O3
-
Учитывая, что соединение в целом нейтрально, т.е. существует равенство суммарных отрицательных и суммарных положительных зарядов степеней окисления, определите степень окисления азота, т.е. «среднего» элемента. +1 ∙ 1 = +1; -2 · 3 = - 6;
+5 –степень окисления азота (+1 +5 = +6). +6 + (-6) = 0.
4. Проверьте правильность определения степеней окисления каждого элемента. (+1) + (+5) = +6; (-2) . 3 = - 6; +6 + (-6) = 0.
+ +5 -2
Na N O3
27. КАК СОСТАВИТЬ МОЛЕКУЛЯРНУЮ ФОРМУЛУ ВЕЩЕСТВА, ИСПОЛЬЗУЯ ПОНЯТИЕ СТЕПЕНИ ОКИСЛЕНИЯ
НАПРИМЕР: Составьте формулу соединения, в состав которого входят кальций и азот.
-
Используя ряд относительной электроотрицательности элементов, определите, какой из них имеет большую электроотрицательность, и, следовательно, отрицательную степень окисления в соединении,а какой – меньшую электроотрицательность и положительную степень окисления.
2. Запишите знаки элементов: на первом месте – знак элемента с положительной степенью окисления, а на втором – с отрицательной:
Са+N-
3.Определите значение положительной степени окисления мене электроотрицательного элемента. Положительная степень окисления равна числу электронов, участвующих в образовании химических связей.
Это могут быть все валентные электроны или только часть из них. (Например, для серы в образовании химической связи с другими атомами возможно участие двух, четырех или шести электронов).
Для кальция степень окисления будет равна +2 (по числу наружных
валентных электронов, способных к отдаче в химических реакциях):
Са+2 N-
-
Определите отрицательную степень окисления более электроотрицательного элемента. Она равна числу недостающих до завершения, т.е. до восьми электронов на внешней оболочке атома данного элемента. Вычислите величину отрицательной степени окисления: Са+2N-3
-
Определите индексы, поделив наименьшее общее кратное для 2 и 3 (6) на модули степеней окисления: Са3+2N2-3
5. Определите отрицательную степень окисления более электроотрицательного элемента. Она равна числу недостающих до завершения, т.е. до восьми электронов на внешней оболочке атома данного элемента. Вычислите величину отрицательной степени окисления: Са+2N-3
6. Определите индексы, поделив наименьшее общее кратное для 2 и 3 (6) на модули степеней окисления: Са3+2N2-3
7. Определите правильность написания формулы, учитывая, что соединение будет устойчивым, если сумма отрицательных и положительных степеней окисления равна нулю:
(+2) . 3 = +6
(-3) · 2 = - 6
+6 + (-6) = 0
Дайте название соединению, формулу которого вы составили, учитывая, что название складывается из латинского названия элемента с отрицательной степенью окисления с прибавлением суффикса – ид и русского названия элемента с положительной степенью окисления.
НАПРИМЕР: Са3+2 N2-3 – нитрид кальция.
28. КАК СОСТАВИТЬ ФОРМУЛУ БИНАРНОГО СОЕДИНЕНИЯ.
НАПРИМЕР: необходимо составить формулу соединения, состоящего из двух химических элементов фосфора и кислорода.
1. При написании химической формулы существует определенный порядок расстановки знаков химических элементов в формуле. Обычно на первом месте записывают знак элемента – металла, а на втором – знак элемента – неметалла. Если в состав соединения входят два элемента – неметалла, то на второе место ставится фтор, хлор, кислород, азот. Запишите в формуле заданного соединения знак фосфора на первом месте, а знак кислорода – на втором.
2. Над знаками элементов проставьте их валентности (валентность фосфора равна пяти).
3. Найдите наименьшее общее кратное валентностей обоих элементов. Наименьшее общее кратное – это наименьшее число, которое делится без остатка на валентности обоих элементов.
4. Поделите наименьшее общее кратное на валентность фосфора. Вы найдете индекс внизу слева от знака элемента фосфора.
5. Найдите индекс элемента кислорода, поделив наименьшее общее кратное на валентность кислорода. Запишите его.
6. Проверьте правильность составления формулы заданного соединения, перемножив индексы на валентности соответствующих элементов. Формула составлена правильно, если полученные числовые значения для каждого элемента, входящего в состав соединения, равны.
7. Название соединения складывается от латинского названия элемента, знак которого стоит на втором месте, с прибавлением суффикса – ид и русского названия элемента, знак которого стоит на первом вместе.
V II
НАПРИМЕР: Р2О5 – оксид фосфора. V · 2 = 10
II · 5 = 10
29. КАК ОПРЕДЕЛИТЬ СТЕПЕНЬ ОКИСЛЕНИЯ ПО ФОРМУЛЕ.
НАПРИМЕР: Определите степень окисления каждого элемента в нитрате натрия.
-
Напишите формулу нитрата натрия - Na NO3.
-
По периодической системе элементов Д.И.Менделеева определите степень окисления натрия и кислорода, т.е. «крайних» элементов. Na и О:
+ -2
Na N O3
-
Учитывая, что соединение в целом нейтрально, т.е. существует равенство суммарных отрицательных и суммарных положительных зарядов степеней окисления, определите степень окисления азота, т.е. «среднего» элемента. +1 ∙ 1 = +1; -2 · 3 = - 6;
+5 –степень окисления азота (+1 +5 = +6).
+6 + (-6) = 0.
9. Проверьте правильность определения степеней окисления каждого элемента. (+1) + (+5) = +6; (-2) . 3 = - 6; +6 + (-6) = 0.
+ +5 -2
Na N O3
30. КАК СОСТАВИТЬ МОЛЕКУЛЯРНУЮ ФОРМУЛУ ВЕЩЕСТВА, ИСПОЛЬЗУЯ ПОНЯТИЕ СТЕПЕНИ ОКИСЛЕНИЯ
НАПРИМЕР: Составьте формулу соединения, в состав которого входят кальций и азот.
1. Используя ряд относительной электроотрицательности элементов, определите, какой из них имеет большую электроотрицательность, и, следовательно, отрицательную степень окисления в соединении,а какой – меньшую электроотрицательность и положительную степень окисления.
2. Запишите знаки элементов: на первом месте – знак элемента с положительной степенью окисления, а на втором – с отрицательной: Са+ N-
3.Определите значение положительной степени окисления мене электроотрицательного элемента. Положительная степень окисления равна числу электронов, участвующих в образовании химических связей.
Это могут быть все валентные электроны или только часть из них. (Например, для серы в образовании химической связи с другими атомами возможно участие двух, четырех или шести электронов).
Для кальция степень окисления будет равна +2 (по числу наружных
валентных электронов, способных к отдаче в химических реакциях): Са+2 N-
4. Определите отрицательную степень окисления более электроотрицательного элемента. Она равна числу недостающих до завершения, т.е. до восьми электронов на внешней оболочке атома данного элемента. Вычислите величину отрицательной степени окисления: Са+2N-3
5. Определите индексы, поделив наименьшее общее кратное для 2 и 3 (6) на модули степеней окисления: Са3+2N2-3
6. Определите правильность написания формулы, учитывая, что соединение будет устойчивым, если сумма отрицательных и положительных степеней окисления равна нулю:
(+2) . 3 = +6
(-3) · 2 = - 6
+6 + (-6) = 0
7. Дайте название соединению, формулу которого вы составили, учитывая, что название складывается из латинского названия элемента с отрицательной степенью окисления с прибавлением суффикса – ид и русского названия элемента с положительной степенью окисления.
НАПРИМЕР: Са3+2 N2-3 – нитрид кальция.
31. КАК НАПИСАТЬ ХИМИЧЕСКУЮ (ЭМПИРИЧЕСКУЮ) ФОРМУЛУ ОРГАНИЧЕСКОГО СОЕДИНЕНИЯ ПО ЕГО НАЗВАНИЮ
|
Написать химическую формулу 3,4 – диметилпентна -1 |
|
|
Последовательность действий |
Выполнение действий |
|
1. Установите по окончанию слова характер связи и принадлежность к гомологическому ряду. |
1 «ен» свидетельствует о наличии двойной связи и указывает на принадлеж-ность к этиленовым углеводородам. |
|
2. Напишите общую формулу гомологического ряда. |
2. Сn Н2n |
|
3. Определите по корню слова и названиям заместителей общее число атомов углерода. |
3. Корень – «пент» и часть слова «диметил» - говорят о наличии семи атомов углерода. |
|
4. Напишите число атомов углерода в формуле. |
4. С7Н2n |
|
5.Определите число атомов водоро- да по общей формуле и напишите химическую формулу вещества. |
5. С7Н14 |
32. КАК СОСТАВИТЬ ЭЛЕКТРОННУЮ И СТРУКТУРНУЮ ФОРМУЛЫ ВЕЩЕСТВ.
НАПРИМЕР: составить электронную и структурную формулы – хлора.
|
Последовательность действий |
Выполнение действий |
|
1.Напишите химическую формулу хлора. |
1. Cl2 |
|
2. Определите, какие элементы входят в состав молекулы и сколько атомов каждого элемента (в данном случае один химический элемент хлор ). |
2. В состав молекулы хлора входят два атома хлора. |
|
3. Напишите химические знаки элементов, входящих в молекулу. |
3. Cl Cl |
|
4. По периодической системе химических элементов Д.И. Менделеева определите общее число электронов каждого элемента и число неспаренных электронов. |
4. Хлор стоит в VII группе, главной подгруппе, значит у него на последней оболочке расположены 7 электронов, причем 1 электрон неспарен- ный. |
|
5. Покажите точками у каждого элемента хлора спаренные электроны (пара точек) и нес- пареные электроны так, чтобы они образовали общую электронную пару с соседним атомом хлора. |
|
|
6. Полученную электронную формулу /пункт5/ преобразуйте структурную, заменив для этого пару точек /общую пару электронов/ черточкой. |
Cl - Cl |
33. КАК СОСТАВИТЬ УРАВНЕНИЕ ОКИСЛИТЕЛЬНО – ВОССТАНОВИТЕЛЬНОЙ РЕАКЦИИ СО СХЕМОЙ ЭЛЕКТРОННОГО БАЛАНСА
НАПРИМЕР: составить уравнение окислительно – восстановительной реакции между хлороводородной (соляной) кислотой и натрием.
|
Последовательность действий |
Выполнение действий |
|
1. Составьте схему химического уравнения. |
1. HCl + Na → Na Cl + H2 |
|
2. Определите и проставьте степень окисления всех элементов в формулах веществ до и после реакции. |
2. H+Cl- + Na0 → Na+ Cl- + H20 |
|
3. Подчеркните элементы, у которых степень окисления изменяется в процессе реакции. |
3. H+Cl- + Na0 →Na+ Cl- + H20 |
|
4. Составьте схему электронного баланса. Количество принятых и отданных электронов в схеме поменяйте местами – это имеет значение для расстановки коэффициентов в уравнении реакции. |
4. Окисли- │ 2Н+ +2 е- →2Н0 │1│ Процесс тель восстан. Восста -│ Na0 – 1е- →Na+│2│ Процесс новитель окислен. |
|
5. Расставьте коэффициенты в схеме химического уравнения, стрелку замените знаком равенства. |
5. 2H+ Cl- + 2 Na0 = 2 Na+ Cl- + H20 |
|
6. Проверьте, правильно ли расставлены коэффициенты в уравнении реакции.
Если в реакции участвует кислород, то в особенности проверяют общую сумму атомов кислорода до и после реакции!
|
|
34. КАК СОСТАИТЬ ЭЛЕКТРОННУЮ СХЕМУ ОБРАЗОВАНИЯ ВЕЩЕСТВА
НАПРИМЕР: составить электронную схему образования сероуглерода.
|
Последовательность действий |
Выполнение действий |
|
1. Составьте химическую формулу данного соединения с учетом степени окисления каждого элемента. |
1. C+4 S2-2 |
|
2. Определите число атомов каждого элемента. |
2. На каждый атом углерода приходится два атома серы. |
|
3. Изобразите с помощью электронных формул атомы, вступающие в химическую связь. |
|
|
4. Изобразите электронную формулу получившегося вещества. |
|
|
5. Проверьте правильность написания электронной формулы соединения. |
5. Атом углерода может дать 4 электрона на образование связей; каждый атом серы на образование связи дает по два электрона. |
35. КАК СОСТАИТЬ УРАВНЕНИЕ РЕАКЦИИ ИОННОГО ОБМЕНА МЕЖДУ РАСТВОРАМИ ЭЛЕКТРОЛИТОВ
НАПРИМЕР: Составить уравнение реакции обмена между солями хлоридом натрия и нитратом серебра.
|
Последовательность действий |
Выполнение действий |
|
1. Напишите уравнение реакции в молекулярном виде. |
1. NaCl + AgNo3 = AgCl + NaNО3 |
|
2.Определите причину, за счет которой реакция обмена идет до конца, и отметьте это в уравнении реакции соответствующим знаком. В данном случае – это выпадение осадка. |
2. Na Cl + Ag NО3 = Ag Cl + NaNО3 |
|
3. Определите вещества, которые диссоциируют на ионы. |
3. NaCl, AgNО3, NaNО3 |
|
4. Установите заряды ионов. |
. 4. Na++ Cl- +Ag+ + NO3- = AgCl + Na+ + +NО3- |
|
5. Отметьте одинаковые ионы до и после реакции, т.е. ионы, которые не принимают участия в реакции. |
5. Na++ Cl- + Ag+ + NO3- = AgCl + Na+ + +NО3- |
|
6. Выпишите строчкой ниже оставшиеся ионы и вещества. |
6. Cl- + Ag+ = Ag Cl↓ |
36. КАК СОСТАВИТЬ ХИМИЧЕСКОЕ УРАВНЕНИЕ РЕАКЦИИ ИСХОДЯ ИЗ СОКРАЩЕННОГО ИОННОГО УРАВНЕНИЯ.
НАПРИМЕР: Составить химическое уравнение реакции, сущность которой выражается так: Си2+ + 2ОН¯ = Сu(ОН)2
|
Последовательность действий |
Выполнение действий |
|
1. Установите причину, вследствие которой реакция идет до конца. |
1.Реакция обмена идет до конца за счёт образования нерастворимого основания гидроксида меди (II) Сu(ОН)2 |
|
2. Подберите по таблице «Растворимость солей, кислот и оснований в воде» вещества, содержащие нужный катион (+) и анион (-). |
2 Растворимые вещества, например: CuCl2 и NаOH |
|
3. Напишите формулы веществ, участвующих в реакции. |
CuCl2 + NaOH → |
|
4. Напишите формулы продуктов, полученных в результате реакции. |
СuCl2 + NaOH → NaCl + Сu(ОН)2 |
|
5. Расставьте, если нужно, коэффициенты. Стрелкой укажите осадок (↓) |
CuCl2 + 2NaOH = 2NaCl + Сu(OH)2↓ |
37. КАК СОСТАВИТЬ УРАВНЕНИЕ РЕАКЦИИ
ГИДРОЛИЗА СОЛИ
НАПРИМЕР: Составить уравнения реакции гидролиза соли карбоната калия.
|
Последовательность действий |
Выполнение действий |
|
1. Напишите химическую формулу соли карбоната калия. |
1. К2СО3 |
|
2. Определите, каким по силе основанием и кислотой образована данная соль (устно). |
2. Соль образована сильным основанием и слабой кислотой. |
|
3. Подчеркните ион либо слабого основания, либо слабой кислоты. |
3. К2СО3 |
|
4. Проставьте степени окисления катиона и аниона. |
4. К2+СО32− |
|
5. Прибавьте молекулу воды, указав в ее формуле степень окисления иона водорода и гидроскид–иона. Поставьте знак обратимости реакции. |
5. К2+СО32− + Н+ОН¯ ↔
|
|
6.После знака обратимости укажите ионы, на которые диссоциирует данная соль, прибавьте молекулу воды и снова поставьте знак обратимости реакции. |
6. К2+СО32− + Н+ОН¯ ↔ ↔ 2К+ + СО32− + Н+ОН¯ ↔ |
|
7. Ион либо слабого основания, либо слабой кислоты будет связываться с противоположным по заряду ионом из молекулы воды, при этом другой ее ион освободится. Ион сильного основания или сильной кислоты участия в реакции не принимает. Отразите это в уравнении реакции, укажите степень окисления нового иона. |
7. К2+СО32− + Н+ОН¯ ↔ ↔ 2К+ + СО32− + Н+ОН¯ ↔ ↔ 2К+ +НСО3− + ОН¯ |
|
Последовательность действий |
Выполнение действий |
|
8. Определите характер среды раствора соли (кислый или щелочной) |
8. Среда раствора соли в данном случае щелочная, т.к. накапливаются освобождающиеся из воды гидроксид–ионы ОН¯. |
|
9. Предположите на основании среды раствора изменение окраски индикатора (лакмус, метилоранж, фенолфталеин). |
9. Фиолетовый лакмус окрасится в синий цвет, метилоранж - в желтый, фенолфталеин – в малиновый. |
|
10. Напишите уравнение реакции гидролиза в молекулярном виде, учитывая, что противоположно заряженные ионы соединяясь образуют молекулы веществ. |
10. К2СО3 + Н2О ↔ КНСО3 + КОН Гидрокарбонат – ион НСО3¯ соединится с ионом К+ с образованием соли гидрокарбоната калия КНСО3, а гидроксид–ион ОН¯ с другим ионом К+- с образованием щелочи КОН. |
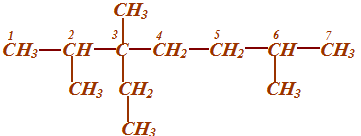
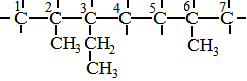
38. КАК НАЗЫВАТЬ ПРЕДЕЛЬНЫЕ УГЛЕВОДОРОДЫ С РАЗВЕТВЛЕННЫМ СТРОЕНИЕМ ПО МЕЖДУКНАРОДНОЙ НОМЕНКЛАТУРЕ
Назвать по международной номенклатуре соединение:
СН3
│
СН3 ─ СН ─ С ─ СН2 ─ СН2 ─ СН ─ СН3
│ │ │
СН3 С2Н5 СН3
|
Последовательность действий |
Выполнение действий |
|
1. Выберите самую длинную и самую сложную углеродную цепь. Если имеются «свернутые» радикалы (ответвления), то их следует «развернуть». |
СН3
СН3 ─ СН ─ С ─ СН2 ─ СН2 ─ СН ─ СН3
СН3 СН2 СН3
СН3 |
|
2. Пронумеруйте атомы углерода, начиная с того конца цепи: а). где ближе ответвление; б). ближе к которому имеется много ответвлений; в). ближе к которому имеется более простой радикал. |
|
|
3. Дайте название, придерживаясь следующей очерёд-ности: а). Сначала напишите, разделив запятой, арабские цифры, соответствующие номерам углеродных атомов, у которых стоят заместители (радикалы); б). Отделите черточкой от последующей части названия; |
3. 2,3,6- триметил- 3-этилгептан. В данном примере разворачивание радикала этила С2Н5 не привело к выделению самой длинной углеродной цепи, поэтому его называ- ют так, как он представлен изначально - этил. |
|
Последовательность действий |
Выполнение действий |
|
в). Если имеется несколько одинаковых радикалов, то укажите их число с помощью приставок (ди-, три-, тетра-, пента- и т.д.) ; г). Назовите боковые цепи (радикалы) в порядке возрастания их сложности, т.е. по « старшенству» – самый простой – самый «старший» (СН3, С2Н5, С3Н7 и др.); д).Назовите самую длин- ную пронумерованную углеродную цепь. |
|
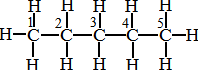
39. КАК СОСТАВИТЬ СТРУКТУРНУЮ ФОРМУЛУ ПРЕДЕЛЬНОГО УГЛЕВОДОРОЖДА НЕРАЗВЕТВЛЕННО- ГО СТРОЕНИЯ ПО ЕГО НАЗВАНИЮ
НАПРИМЕР: Составить структурную формулу нормального пентана
|
Последовательность действий |
Выполнение действий |
|
1. Определите число атомов углерода по корню слова, обозначающего название вещества. |
1. «Пент» - обозначает «пять». |
|
2. Установите характер химической связи в молекуле по окончанию слова, обозначающего название вещества. |
2. – «ан» свидетельствует об одинарных связях в молекуле – это предельный углеводород. |
|
3. Составьте углеродную цепь по числу установленных атомов углерода. |
3.3.
|
|
Последовательность действий |
Выполнение действий |
|
1. Определите число атомов углерода по корню слова, обозначающего название вещества. |
1. «Пент» - обозначает «пять». |
|
2. Установите характер химической связи в молекуле по окончанию слова, обозначающего название вещества. |
2. – «ан» свидетельствует об одинарных связях в молекуле – это предельный углеводород. |
|
3. Составьте углеродную цепь по числу установленных атомов углерода. |
3.3.
|
|
4. Пронумеруйте атомы углерода в цепи. |
4.
|
|
5. Обозначьте черточками недостаю- щие единицы валентности у атомов углерода. |
5.
|
|
6. Напишите у каждой «свободной» единицы валентности знаки атомов водорода. |
6.
|
40. КАК СОСТАВИТЬ СТРУКТУРНУЮ ФОРМУЛУ ВЕЩЕСТВА РАЗВЕТВЛЕННОГО СТРОЕНИЯ ПО ЕГО НАЗВАНИЮ
НАПРИМЕР: составить структурную формулу 2,6 диметил – 3 – этилгептана
|
Последовательность действий |
Выполнение действий |
|
1. Определите число атомов углерода по корню слова, обозначающего название вещества. |
1.- «гепт»- обозначает «семь». |
|
2. Установите характер химической связи молекуле по окончанию слова, обозначающего название вещества. |
2.- «ан»- свидетельствует об ординарных связях в молекуле, это предельный углеводород. |
|
3. Напишите углеродную цепь из 7 атомов углерода. |
3.
|
|
4. Пронумеруйте атомы углерода в цепи. |
4.
|
|
5. Напишите радикалы к соответствующим атомам углерода в цепи. |
5.
|
|
6.Обозначьте черточками недостающие единицы валентности. |
6.
|
|
7. Напишите у каждой «свободной» единицы валентности недостающие атомы водорода. |
7. |
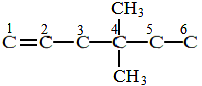
42. КАК СОСТАВИТЬ СТРУКТУРНУЮ ФОРМУЛУ ВЕЩЕСТВА ПО ЕГО НАЗВАНИЮ ПОСЛЕ ИЗУЧЕНИЯ РАЗЛИЧНЫХ КЛАССОВ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
НАПРИМЕР: составить структурную формулу 4,4 – диметилгексена – 1
|
Последовательность действий |
Выполнение действий |
|
1. Определите по составу, т.е. по названию данного вещества, число атомов углерода, характер связи, число радикалов – замести- телей или функциональных групп и принадлежность да-нного вещества к определён-ному классу соединений. |
1. - «гекса» - обозначает «шесть», суффикс «ен» свидетельствует о наличии двойной связи, цифра 1 после окончания свидетельствует о расположении двойной связи между первым и вторым атомами углерода, приставка «ди» свидетельствует о наличии двух одинаковых радикалов – заместителей. |
|
2. Напишите углеродную цепь и пронумеруйте атомы углерода. |
2.
|
|
3. Напишите кратные связи, радикалы – заместители, или функциональную группу. |
3.
|
|
4. Напишите недостающие атомы водорода в углеродном скелете. |
4.
|
43. Памятка по оценке и самооценке ответа обучающегося.
Оценка ответов обучающихся производится в соответствии с 5-ю критериями структуры ответа:
1. Адекватность ответа (соответствие ответа вопросу) – является ли ответ ответом на заданный вопрос.
2. Аргументированность (обоснованность ответа) – имеются доказательства, аргументы, рассуждения.
3. Использование различных средств информации – учебник, научная, научно-популярная литература, периодические издания, Интернет.
4. Использование различных способов представления информации – таблицы, схемы, графики, диаграммы, рисунки и др.
Оценивание производится по следующей шкале:
«2» –не проявляется;
«3» – проявляется слабо;
«4» – проявляется на достаточном, хорошем уровне;
«5» – проявляется на высоком, отличном уровне.
Пояснения к критериям оценки и самооценки ответов обучающихся
1. Адекватность ответа (соответствие ответа вопросу).
Адекватный ответ будет содержать соответствующие ключевые слова («такой-то», «такие-то», «потому что», «из-за», «по причине», «для того, чтобы» и другие).
Неадекватный ответ выглядит как последовательность случайных ассоциаций, вызванных каким-либо словом или выражением. Отвечающий по рассеянности или намеренно «уходит» от вопроса, переключившись на второстепенный, случайный предмет.
2. Аргументированность (обоснованность ответа) - имеются доказательства, аргументы, рассуждения.
Обнаружить аргументы или их отсутствие несложно: после высказывания главной мысли (основного ответа) должно последовать доказательство, развитие мысли («потому что», «так как»).
3. Использование различных источников информации.
Распространёнными источниками информации, необходимой для доказательства, являются учебная литература, специальная литература, СМИ.
Отсутствие упоминания хотя бы одного из источников информации делает сообщение неубедительным. Делая ссылку на источник информации (статья периодического издания, информация, полученная по сети Интернет, необходимо указывать автора тех или иных суждений).
-
Выражение собственной позиции – высказывание личного отношения, собственного мнения.
Отвечающий сообщает в своём выступлении «по-моему», «я думаю», «я считаю». Это является личной ответственностью за содержание ответа, высказывания. Но просто наличие оборота «я считаю» не является источником доказательства. Обязательно необходима ссылка на источник информации, с которым выступающий выражает своё согласие (несогласие).
Личная позиция обычно включает эмоционально-ценностный компонент – одобрение, возмущение, восхищение и т.д.
3. Использование различных способов представления информации (таблиц, схем, графиков, диаграмм, рисунков, электронных презентаций и т. д.).
Отметить наличие названных элементов и оценить их уместность.
Возможные ошибки: 1). Объёмные ответы старшеклассников – одна и та же мысль повторяется несколько раз.
2). Таблиц и графиков много, но отсутствуют выводы на их основе.
3). Таблица приводится в доказательство второстепенного, не очень важного утверждения, не является ответом на основной вопрос.
Советы для избежания ошибок:
-
Для любителей многословного изложения. Используйте логические цепочки, блок-схемы как способы передачи особо важных мыслей.
-
Используете таблицы и графики - делайте краткие выводы по каждой таблице или графику.
-
Умеете по-разному представить информацию – имеете большие преимущества экономично и быстро донести нужную информацию до слушателей, как в деловой, так и в личной сфере.
Оценка и самооценка обучающегося
Класс: ________ Ученик (ца): _____________________
Тема (вопрос): __________________________________
|
Критерий ответа
|
|
|
|
|
|
Адекватность
|
|
|
|
|
|
Аргументированность
|
|
|
|
|
|
Средства информации
|
|
|
|
|
|
Собственная позиция
|
|
|
|
|
|
Способы представления информаци |
|
|
|
|
Критерии оценки проектной исследовательской работы
-
Корректность формулировки темы, соответствие текста объявленной теме (от 0 до 5 баллов).
-
Оригинальность и ценность собранного документального материала (от 0 до 10 баллов).
-
Исследовательское мастерство: умение непротиворечиво использовать собранный материал и делать аргументированные выводы (от 0 до 10 баллов).
-
Композиция: логика работы, структура (от 0 до 6 баллов).
-
Язык и стиль изложения (от 0 до 5 баллов).
-
Культура оформления работы: наличие справочного аппарата, библиографии, этика цитирования (от 0 до 3 баллов).
Общее впечатление (от 0 до 10 баллов).
КАК СОСТАВИТЬ РЕЦЕНЗИЮ НА РАБОТУ (ОТВЕТ) ОБУЧАЮЩЕГОСЯ.
1.Краткое содержание ответа.
2.Характеристика полноты ответа (освещены ли все аспекты заданной темы).
3.Характеристика глубины ответа (достаточны ли обоснования, доказательства и примеры).
4.Дополнения к ответу.
5.Общая характеристика ответа.
- Международный вебинар «Волонтёрство и новые воспитательные практики в школе»
- Вебинар «Речевое развитие детей дошкольного возраста в разных видах деятельности (ФГОС ДО)»
- Международный вебинар «Обучение грамоте старших дошкольников с помощью развивающих игр В. В. Воскобовича: практика реализации ФГОС и ФОП ДО»
- Международный вебинар «Современные методы нейрореабилитации и нейрокоррекции. Нейропсихологическая коррекция в системе комплексной реабилитации. Общий анализ принципов коррекционного и восстановительного обучения в нейродефектологии»
- Современные тенденции развития шахматного образования в РФ. Научные идеи и концепции обучения шахматной игре
- Вебинар «Современные технологии речевого развития детей дошкольного возраста: синквейн, мнемотехника, ТРИЗ, РТВ»