Муниципальное автономное общеобразовательное учреждение
«Миасская средняя общеобразовательная школа №20»

Методическая разработка обобщающего урока
по теме «Неметаллы»
Химия 9 класс
Урок обобщения и систематизации знаний учащихся по химии
Автор: учитель химии
высшей квалификационной категории
Ананьина Наталия Владимировна
Обобщающий урок по теме
« Неметаллы».
Цель урока:
1.Обобщить, систематизировать изученный материал, ликвидировать имеющиеся пробелы в знаниях. Подготовиться к контрольной работе.
2.Развивать умения анализировать, обобщать изученный материал, делать выводы.
3.Повышать интерес к изучаемому предмету.
Ход урока.
1. Сегодня на уроке мы:
- вспомним, где находятся неметаллы в П.С.;
- дадим краткую сравнительную характеристику неметаллам;
- вспомним характерные химические свойства неметаллов и их соединений;
- повторим решение основных типов задач.
2. Для этого к доске пойдут:
- Ученик 1. для ответа на вопрос «Сравните окислительные и кислотные свойства серной и азотной кислот. Ответ подтвердите уравнениями реакций».
- Ученик 2. для ответа на вопрос «Сравните о-в и кислотные свойства оксида серы (4) и оксида углерода (4). Ответ подтвердите уравнениями реакций».
- Ученик 3. для ответа на вопрос: «Охарактеризуйте основные и восстановительные свойства аммиака».
3. Беседа с классом:
- «Где находятся НеМе в П.С.Х.Э.?»
Он с морской капустой дружен
И лекарством людям служит
Знает млад и стар народ –
Коль ушиб, то нужен …….(йод)
У меня дурная слава
Я – известная отрава,
Даже имя говорит,
Что я страшно ядовит. (бром)
- Дайте краткую характеристику элементам главной подгруппы 7 группы (Ученик 4).
Нам шестое место лишь досталось,
Но по праву надо выйти нам вперёд,
Как бы всем жилось, работалось, дышалось,
Если бы не верный ………(кислород)
- Дайте краткую характеристику элементам главной подгруппы 6 группы (Ученик 5).
Предупреждаю я заранее,
Что не пригоден для дыхания,
А все как будто бы не слышат
И постоянно мною дышат.
Я главный в воздухе, так вот
Легко назвать меня? ………(азот)
Я – светоносный элемент
Я спичку вам зажгу в момент,
Сгореть смогу и под водой,
Оксид в ней станет кислотой. (фосфор)
- Дайте краткую характеристику элементам главной подгруппы 5 группы (Ученик 6).
Нас два неметалла на группу всего
Но это не значит еще ничего
Мы с кремнием братья и только вдвоем
Природу веками трудом создаем. (углерод и кремний)
- Дайте краткую характеристику элементам главной подгруппы 4 группы (Ученик 7).
- Обобщите, какие свойства характерны всем неметаллам (Ученик 8).
4. Программированный опрос.
-Химч.элемент фтор обладает самой высокой электроотрицательностью.
- Кислород и озон – аллотропные модификации.
- Хлор, фтор, бром, йод - газы при н.у.
- Молекулы кислорода, азота, галогенов образованы ковалентной неполярной связью.
- Степени окисления кислорода от -2 до +6.
- Последний энергетический уровень атома фосфора имеет электронную конфигурацию 3 3
- Атомную кристаллическую решетку имеют простые вещества, образованные углеродом и кремнием.
Самопроверка с доски.
5. Прослушивание монологических ответов.
6. В это время класс выполняет задания (решение задач с последующей проверкой). Три расчетные задачи.
7. Тестовый контроль знаний.
8. Итог.
План характеристики
элементов главных подгрупп.
1. Состав подгруппы (указать, какие элементы входят в подгруппу)
2. Строение атома
а) число электронов на последнем энергетическом уровне;
б) электронная конфигурация последнего энергетического уровня;
в) к какому семейству элементов принадлежат;
г) степени окисления.
3. Закономерности изменения свойств
а) радиусы атомов;
б) окислительная способность;
в) неметаллические свойства.
4. Аллотропные видоизменения.
5. Молекулярная формула.
6. Агрегатное состояние.
Задача.
К раствору, в котором находится 42,6 грамм нитрата алюминия, прилили раствор, содержащий 16 грамм гидроксида натрия. Рассчитайте массу образовавшегося осадка.
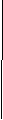
Дано: Решение:
m ( AI (NO3)3) = 42,6г AI (NO3)3 + 3 NaOH → AI(OH)3 ↓+3NaNO3
m
(NaOH) = 16г 1. ۷
(AI (NO3)3)
=
![]() = 0,2 моль.
= 0,2 моль.
 2.
۷
(NaOH) =
2.
۷
(NaOH) =
![]() =
0,4 моль.
=
0,4 моль.
m (осадка)? 3. Так как исходные вещества по уравнению реакции реагируют как 1:3, то нитрат алюминия дан в избытке.
4. ۷(AI(OH)3)=
![]() ۷(NaOH)
=
۷(NaOH)
=![]() ×0,4моль
= 0,13 моль.
×0,4моль
= 0,13 моль.
5. m (AI(OH)3) = 0,13 ×78= 10,14 г
Ответ: m (AI(OH)3) = 10,14 г
План анализа решения задачи.
1. Тип задачи.
2. Какие вещества участвуют в реакции.
3. Тип химической реакции.
4. Алгоритм решения задачи.
5. Какие формулы используются при решении задачи.
6. Определите массу нитрата алюминия, не вступившего в реакцию.
Задача.
На гидроксид натрия, взятый в необходимом количестве, подействовали раствором, содержащим 252 грамма азотной кислоты. Вычислите массу полученной соли, если практический выход составляет 90% от теоретического.
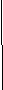
Дано: Решение:
m (HNO3) = 252 г HNO3 + NaOH → NaNO3 + H2O
W
(выхода) = 90% 1. ۷
(HNO3)
=
![]() = 4 моль.
= 4 моль.
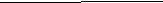
m(соли) - ? 2. ۷ (NaNO3) = ۷ (HNO3) = 4 моль.
3. m (NaNO3) = 4 моль × 85г/моль = 340г
4. m
пр.=
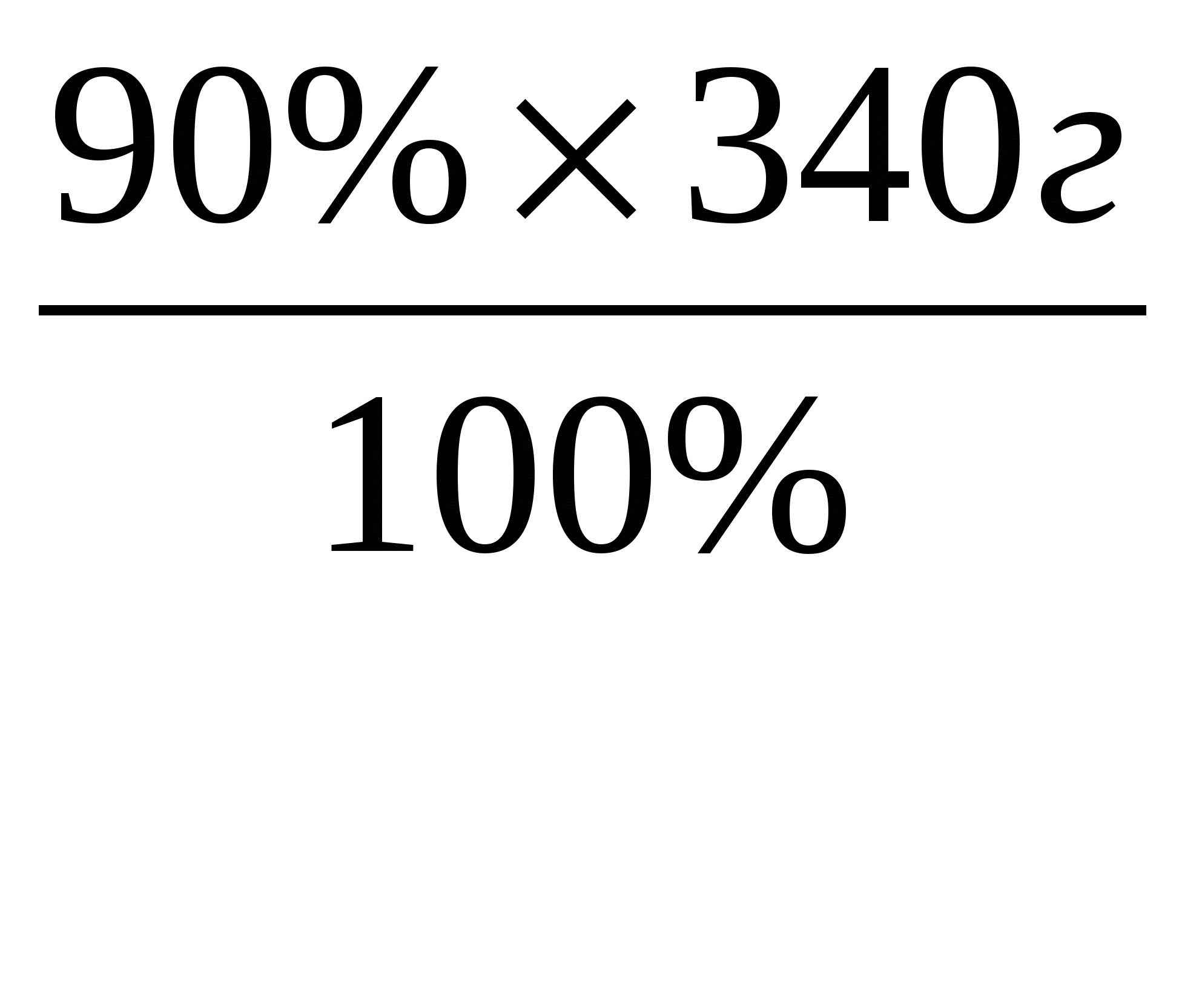 =306г.
=306г.
Ответ: m(соли) = 306г
План анализа решения задачи.
1. Тип задачи.
2. Какие вещества участвуют в реакции.
3. Тип химической реакции.
4. Алгоритм решения задачи.
5. Какие формулы используются при решении задачи.
6.Определить потери производства в процентах и граммах.
Задача.
Какую массу оксида кальция можно получить при термическом разложении 600грамм известняка, содержащего 10% примеси?
Дано: Решение:
m (известняка) =600г Сa CO3 → Ca O + CO2 ↑
w (примесей) = 10% 1. w
(Сa CO3) = 100% - 10% = 90%
(примесей) = 10% 1. w
(Сa CO3) = 100% - 10% = 90%
m (CaO) =?
2. m (Сa
CO3)
=
![]() =
540г
=
540г
3. ۷
(Сa
CO3)
=
![]() =5,4моль
=5,4моль
4. ۷ (Ca O) = ۷ (Сa CO3) = 5,4моль
5 .
m (CaO) = 5,4моль
× 56г/моль =302,4г.
.
m (CaO) = 5,4моль
× 56г/моль =302,4г.
Ответ: m (CaO) = 302,4г
План анализа решения задачи.
1. Тип задачи.
2. Какие вещества участвуют в реакции.
3. Тип химической реакции.
4. Алгоритм решения задачи.
5. Какие формулы используются при решении задачи.
6.Какова масса примесей?
|
Урок-обобщение по теме «Неметаллы». Тест 1 вариант |
Урок-обобщение по теме «Неметаллы». Тест 2 вариант |
|
1. Какие из перечисленных химических элементов относятся к неметаллам? а) Al б) N в) Cu г) C
2. Какие из указанных неметаллов образуют двухатомные молекулы? а) сера б) водород в) кислород г) углерод д) бром
3. Какие из указанных соединений образуют водородные соединения типа ЭН3 ? а) сера б) фосфор в) углерод г) бром
4. Какой из указанных оксидов образует кислоту типа Н2ЭО3 ? а) CO2 б) N2O5 в) SO3 г) CO д) SO2
5. Какие из приведенных неметаллов образуют высший оксид типа Э2О5 ? а) сера б) углерод в) азот г) фосфор д) фтор |
1. Какой из указанных неметаллов является самым сильным окислителем? а) сера б) кислород в) азот г) фтор д) йод
2. В каком из соединений кислород проявляет степень окисления (-1)? а) Li2O б) OF2 в) Cl2O г) Na2O2
3.В каких реакциях сера является окислителем? а) Li + S б) S + O2 в) H2 + S г) S + F2
4. С какими веществами реагирует разбавленная серная кислота? а) Hg б) Al2O3 в) CaSO4 г) Cu
5. В каком соединении сера имеет степень окисления (+4) ? а) CuSO4 б) FeS в) H2SO3 г) Li2S |
|
Урок-обобщение по теме «Неметаллы». Тест 3 вариант |
Урок-обобщение по теме «Неметаллы». Тест 4 вариант |
|
1. Какой из перечисленных элементов не образует аллотропных модификаций? а) кислород б) азот в) фосфор г) сера
2. В окислительно-восстановительных реакциях азотная кислота может участвовать в качестве: а) только восстановителя б) только окислителя в) как восстановителя, так и окислителя
3. Какое из перечисленных веществ имеет молекулярную кристаллическую решётку? а) графит б) алмаз в) кварц г) углекислый газ
4. Из какого вещества состоит «сухой лёд»? а) аммиак б) угарный газ в) углекислый газ г) вода
5. Как изменяются неметаллические свойства в ряду: Ge, As, Se, Br ? а) уменьшаются б) увеличиваются в) не изменяются
|
1. Какое из перечисленных веществ проводит электрический ток? а) графит б) алмаз в) кварц г) углекислый газ
2. Каким образом можно отличить азот от аммиака? а) по цвету б) по реакции со щелочью в) по растворимости в воде г) по запаху
3. Уголь может участвовать в окислительно-восстановительных реакциях а) только окислителем б) только восстановителем в) как окислителем, так и восстановителем
4. Какие вещества образуются при полном сгорании сероводорода H2S в избытке кислорода: а) H2 и S б) SO3 и H2O в) H2 и SO2 г) H2O и SO2
5. В каком из перечисленных соединений степень окисления азота равна (-3) ? а) N2O3 б) HNO2 в) NH4Br г) NH3 |
|
Урок-обобщение по теме «Неметаллы». Тест 5 вариант |
Урок-обобщение по теме «Неметаллы». Тест 6 вариант |
|
1. Угарный газ может участвовать в окислительно-восстановительных реакциях в качестве: а) только восстановителя б) только окислителя в) как восстановителя, так и окислителя
2. Каким образом можно отличить углекислый газ от азота: а) по запаху б) по действию на известковую воду в) по действию на горящую лучину
3. Какое из перечисленных веществ обладает наилучшей растворимостью в воде? а) азот б) красный фосфор в) водород г) аммиак
4. Раствор какого вещества является реактивом на ион аммония? а) сульфата калия б) гидроксида натрия в) хлорида бария г) нитрата серебра (I)
5. У какого элемента наиболее ярко выражены неметаллические свойства ? а) теллур б) сера в) селен г) кислород
|
1. В качестве реагента на сульфат-ион можно использовать раствор, содержащий катионы: а) Ba2+ б) H+ в) Cu2+ г) Fe2+
2. В каких реакциях сера является окислителем? а) Li + S б) S + O2 в) H2 + S г) S + F2
3. Какие из указанных соединений образуют водородные соединения типа ЭН3 ? а) сера б) фосфор в) углерод г) бром 4. Каким способом получают аммиак в промышленности: а) соединением азота с водородом б) разложением солей аммония в) восстановлением оксида азота водородом г) взаимодействием солей аммония с гидроксидом кальция
5. В каком из перечисленных соединений углерод имеет наименьшую степень окисления? а) СO б) СO2 в) СH4 г) ССl4 |
- Международный вебинар «Лицевая гимнастика: комплексы упражнений, подготовка и методика проведения»
- Вебинар «Игры-эксперименты с дошкольниками: воспитываем потребность в познавательном общении со взрослыми, стремление наблюдать, сравнивать, исследовать, устанавливать причинно-следственные связи (ФОП ДО)»
- Вебинар «Краеведческая работа библиотек как средство интеграции в социокультурное пространство региона: традиционные формы, новые технологии»
- Международный вебинар «Приоритетные ориентиры в системе “государство – отдых – ребёнок”, принципиальные подходы к сфере отдыха и оздоровления детей, современные формы, методы и технологии организации отдыха и оздоровления детей»
- Международный вебинар «Создание безопасной образовательной среды в образовательной организации в рамках реализации федерального проекта “Цифровая образовательная среда”»
- Международный вебинар «Цифровые образовательные ресурсы, дистанционные образовательные технологии, электронное обучение в работе с обучающимися с нарушениями зрения»