![]()
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ, МОЛОДЕЖИ И СПОРТА УКРАИНЫ
МАКЕЕВСКОЕ ПРОФЕССИОНАЛЬНО – ТЕХНИЧЕСКОЕ УЧИЛИЩЕ СФЕРЫ УСЛУГ
Урок - исследование “Белки: строение, свойства. Функции белков” (10 класс).
Подготовила:
Малюта Анна Михайловна,
преподаватель биологии и химии
г. Макеевка - 2013
Аннотация
Урок-исследование построен в виде рассказа с использованием флеш-анимации, которая отражает динамику процесса и помогает ученикам в освоении новой темы.
Для актуализации ранее полученных знаний применяется биологический диктант, позволяющий проверить и обобщить знания учеников, выяснить общую картину понимания темы и обнаружить типичные недостатки в ее усвоении.
С целью мотивации учебной деятельности применяется метод кластеров, позволяющий сделать наглядными мыслительные процессы, помогает развивать память.
Итогом изучения нового материала является синквейн как инструмент для синтезирования сложной информации и оценки понятий.
10 класс
Тема: Белки: строение, свойства. Функции белков.
Цели:
образовательные: сформировать основные понятия о строении и свойствах белка, изучить пространственную организацию и химические связи, стабилизирующие структуру белка, расширить знания учащихся о многообразии функций белка.
воспитательные: воспитать интерес к предмету.
развивающие: развивать умение выделять главное, самостоятельность, творческий поход в изучении материала.
Тип урока: урок изучения нового учебного материала.
Вид урока: урок-исследование.
Базовые понятия: белки, аминокислоты, амфотерность, протеины, протеиды, простетическая группа, изоэлектрическая точка, высаливание, денатурация, ренатурация, деструкция, пептид, полипептид, конформация белка, фибриллярный белок, глобулярный белок, субъединица (протомер), олигомер.
Методи и приемы работы: биологический диктант, метод кластеров, синквейн, визуальный, словесная передача информации.
Межпредметные связки: биология, химия, физика.
Оборудование: компьютер, проектор, флеш-анимация “Функции белков”.
Литература
а) использованная преподавателем:
1. Биология: учебн. для 10 кл. общеобразоват. учебн. заведений.: уровень стандарта, академический уровень / П. Г. Балан, Ю. Г. Вервес, В. П. Полищук.—К.: Генезис, 2010. —288 с.: ил.
2. Тиманюк В. О., Животова О. М. Биофизика:Учебн. для студ. выш. учеб. завед.— Х.: Изд-во НФаУ; Золотые страницы, 2003.— 704 с.: ил.
3. http://www.berl.ru/article/forabit/citologiya/ximiya.htm Химический состав клеток.
4. http://xreferat.ru/108/439-1-himiya-belka.html Химия белка.
б) рекомендованная ученикам:
1. Общая биология: учебн. для 10 кл. общеобразоват. учебн. заведений /М. Е. Кучеренко, Ю. Г. Вервес, П. Г. Балан, В. М. Войцицкий.— Генезис, 2001. —160 с.: ил.
2. Биология: учебн. для 10 кл. общеобразоват. учебн. заведений.: уровень стандарта, академический уровень / П. Г. Балан, Ю. Г. Вервес, В. П. Полищук.—К.: Генезис, 2010. —288 с.: ил.
3. С. Т. Исмаилова. Энциклопедия для детей. Т.2. Биологии / Сост. С. Т. Исмаилова.- Э68 3-е изд. перераб. и доп.- М.: Аванта+, 1996.- 704с.: ил.
Жизнь есть способ существования белковых тел, существенным моментом которого является постоянный обмен веществ с окружающей их внешней природой, причем с прекращением этого обмена веществ прекращается и жизнь, что приводит к разложению белка.
Ф.Энгельс
Ход урока
І. Организационный момент (1мин).
ІІ. Актуализация опорных знаний учеников (2 мин).
ІІІ. Мотивация учебной деятельности учеников (2 мин).
IV. Изучение нового учебного материала (30 мин).
V. Обобщение и систематизация материала, который изучался (8 мин).
VI. Подведение итогов (1 мин).
VII. Сообщение домашнего задания (1 мин).
І. Организационный момент.
ІІ. Актуализация опорных знаний учеников.
Биологический диктант по теме: “Углеводы разнообразие, свойства и функции”.
Поставьте возле каждого вопроса “+”, если согласны с утверждением и “-”, если не согласны.
1. Фруктоза в небольших количествах содержится в плодах и листьях зелёных растений.
2. Сахароза является углеводной основой РНК и ДНК.
3. Глюкоза является основным структурным компонентом клеточной стенки растений.
4. Лактоза - волокнистое вещество, нерастворимое ни в воде, ни в обычных органических растворителях.
5. К моносахаридам относятся крахмал и целлюлоза.
6. Сахароза состоит из ковалентно присоединенных друг к другу глюкозы и фруктозы.
7. Хитин выполняет опорную и защитную функции.
8. Второе название сахарозы – виноградный сахар.
9. Мальтоза – солодовый сахар, содержится в солоде, в проросшем зерне.
10. Широко применяют фруктозу в кондитерском деле, в текстильной промышленности в качестве восстановителя, в качестве исходного продукта при производстве аскорбиновой кислоты, для синтеза ряда производных сахаров.
Ключ:
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
+ |
- |
- |
+ |
- |
+ |
+ |
- |
+ |
- |
ІІІ. Мотивация учебной деятельности учеников.
Сегодня на уроке предметом нашего исследования будет белок.
Белки – основа организации живой материи. Знание химической структуры и биологических функций белков необходимо для понимания механизма реализации наследственной информации в клетке и доказательства уникальности каждого живого организма.
Мы поговорим о строении и свойствах белка, изучим пространственную организацию, химические связи и функции белка. В конце нашего урока мы попробуем повторить главные моменты урока, выполнив синквейн.
Перед тем, как перейти к изучению нового учебного материала, давайте поиграем в игру “Ассоциации”. (Ученики придумывают слова - ассоциации к теме урока, используя свои знания и учебник. Затем ученики составляют кластер из названных слов и сравнивают его с кластером, подготовленным преподавателем. Лучший кластер ученики оформляют в тетрадях.)
IV. Изучение нового учебного материала.
Объяснение преподавателя.
-
ЧТО ТАКОЕ БЕЛКИ. АМИНОКИСЛОТЫ - СОСТАВНЫЕ ЧАСТИ БЕЛКОВ, ИХ ХИМИЧЕСКОЕ СТРОЕНИЕ.
БЕЛКИ (ПРОТЕИНЫ) - это высокомолекулярные азотсодержащие органические вещества, линейные гетерополимеры, структурным компонентом которых являются аминокислоты, связанные пептидными связями. В состав белковых молекул входят следующие химические элементы: С, Н, О, N, P, S.
Белки – биополимеры, мономерами которых являются α - аминокислоты.
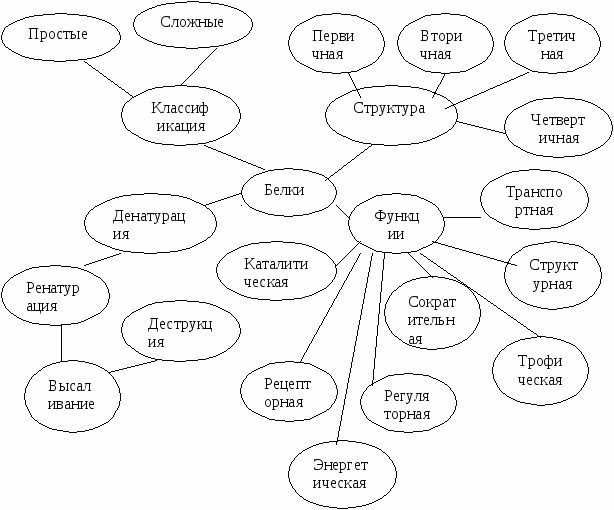
α - Аминокислоты - производные карбоновых кислот, у которых один водородный атом, у α- углерода, замещен на аминогруппу (-NH2) (рис. 1).
α
R – CH - COOH
I
NH2
Рис. 1. Общая формула аминокислоты.
В составе природных белков встречается 20 аминокислот. Аминокислоты разделяют на заменимые (глутаминовая кислота, глутамин, пролин, аланин, аспарагиновая кислота, аспарагин, тирозин, цистеин, серин и глицин), которые синтезируются в самом организме и незаменимые (эссенциальные) (валин, лейцин, изолейцин, лизин, треонин, метионин, фенилаланин, триптофан.), которые животный организм получает с пищей. К частично незаменимым аминокислотам относятся аргинин и гистидин.
При образовании белков аминокислоты соединяются в полимерные цепи с отщеплением молекул воды (реакция полимеризации).
Все встречающиеся в природе аминокислоты обладают общим свойством – амфотерностью (содержат кислотную и основную группы). Аминокислоты будут отличаться друг от друга химической природой радикала R (может содержать алифатические, ароматические, гидроксильные, карбоксильные группы и включать атомы С, Н, О, N, S), не участвующего в образовании пептидной связи при синтезе белка. Именно благодаря радикалам белки наделены рядом уникальных функций, не свойственных другим биополимерам, и обладают химической индивидуальностью.
2. КЛАССИФИКАЦИЯ БЕЛКОВ
В зависимости от химического состава белки разделяют на простые и сложные.
Простые (протеины) состоят из аминокислотных остатков. Различают:
1) альбумины (сывороточный альбумин – главный транспортный белок крови);
2) глобулины (γ-глобулин (антитела)).
Сложные белки (протеиды) содержат два компонента: белковую и небелковую часть (остатки фосфорной и нуклеиновой кислот, углеводов, липидов, атомы железа, цинка, меди), называемую простетической группой. В зависимости от характера этой группы различают:
1) нуклеопротеиды (дезоксирибонуклеопротеид - основной компонент хромосом);
2) гликопротеиды (гликофорины – белки, определяющие группу крови);
3) липопротеиды (липопротеиды низкой и высокой плотности – играют роль в обмене холестерина);
4) хромопротеиды (гемоглобин – железосодержащий пигмент крови, миоглобин – окрашивает мышцы);
5) металлопротеиды (трансфери – белок-переносчик железа);
6) фосфопротеиды (казеин молока).
3.ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА БЕЛКОВ: МОЛЕКУЛЯРНАЯ МАССА, РАСТВОРИМОСТЬ, ИЗОЭЛЕКТРИЧЕСКАЯ ТОЧКА, ВЫСАЛИВАНИЕ, ДЕНАТУРАЦИЯ, РЕНАТУРАЦИЯ, ДЕСТРУКЦИЯ.
Аминокислотный состав и пространственная организация каждого белка в отдельности различны. Они обладают амфотерными, буферными, коллоидными и осмотическими свойствами.
Белки имеют большую молекулярную массу. Молекулярная масса белков колеблется от 6000(нижний предел) до 1000000 и выше в зависимости от количества полипептидных цепей в составе единой молекулярной структуры белка. Это в тысячи и десятки тысяч раз больше, чем молекулярная масса неорганических соединений.
Изоэлектрическая точка (ИЭТ, pI) большинства белков животных тканей лежит в пределах от 5,5 до 7,0. В изоэлектрической точке суммарный заряд белков равен нулю и белки не перемещаются в электрическом поле, наименее устойчивы в растворе и легко выпадают в осадок (рис. 2).
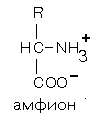
Рис. 2. Суммарный заряд белка в изоэлектрической точке.
Растворимость различных белков колеблется в широких пределах, что зависит от структуры белка (полярные аминокислоты придают большую растворимость). Альбумины растворимы в воде и слабых растворах солей, протамины - в 60-80-% спирте, а коллаген и кератины нерастворимы в большинстве растворителей.
Стабильность растворам белков придают заряд белковой молекулы и гидратная (сольватная) оболочка (рис. 3).
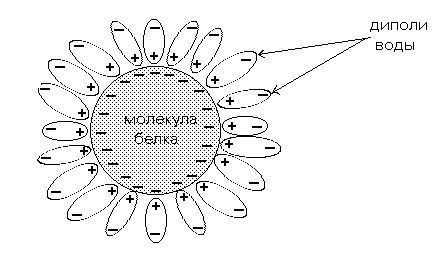
Рис. 3. Гидратная оболочка молекулы белка.
Между зарядом белка и гидратацией существует тесная связь: чем больше полярных аминокислот в белке, тем больше связывается воды. Некоторые белки гидратируются сильнее, а растворяются хуже. Например, коллаген связывает воды больше, чем многие хорошо растворимые глобулярные белки, но не растворим в воде.
Высаливание белков – это обратимый процесс выпадения белков в осадок, причиной которого могут служить соли щелочных и щелочноземельных металлов, поскольку такие соли очень гидрофильны и обладают в высоких концентрациях водоотнимающими свойствами. По мере добавления таких солей к раствору белка они сначала растворяюся в свободной воде, а затем, при дальнейшем повышении концентрации соли, конкурируют с белком за обладание водой, которая входит в состав гидратных оболочек. Белки менее гидрофильны, плохо удерживают воду гидратной оболочки и теряют ее раньше. После удаления солей белок возвращается в свое нативное состояние.
Разрушение структуры белка и потеря им своих нативных свойств (биологических, физико-химических) называется денатурацией. Первичная структура при этом сохраняется, потому что она сформирована прочными ковалентными связями. Осажденный денатурированный белок, в отличие от белка, осажденного путём высаливания, утрачивает свои нативные свойства.
Денатурирующие факторы делятся на:
1) физические (температура, радиация, ультрафиолетовое излучение)
2) механические (вибрация и т.д.)
3) химические (концентрированные кислоты, щелочи, соли тяжелых металлов и т.д.)
При непродолжительном действии и быстром удалении денатурирующих агентов возможна ренатурация белка с полным восстановлением исходной трехмерной структуры и нативных свойств его молекулы (рис. 4).
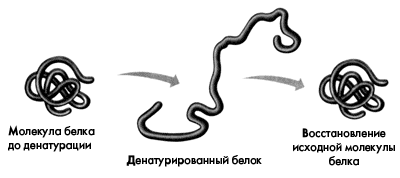
Рис. 4. Денатурация и ренатурация белковой молекулы.
Деструкция – необратимый процесс нарушения первичной структуры белков.
4. СОВРЕМЕННЫЕ ПРЕДСТАВЛЕНИЯ О СТРОЕНИИ БЕЛКОВОЙ МОЛЕКУЛЫ:
ПЕРВИЧНАЯ, ВТОРИЧНАЯ, ТРЕТИЧНАЯ И ЧЕТВЕРТИЧНАЯ СТРУКТУРЫ (ПРОСТРАНСТВЕННАЯ ОРГАНИЗАЦИЯ, ХИМИЧЕСКИЕ СВЯЗИ)
В основе каждого белка лежит полипептидная цепь. Пептидом обычно называют олигомер, состоящий не более чем из 10 аминокислот. Но встречаются и молекулы, содержащие от 10 до 100 аминокислот – они относятся к группе небольших полипептидов, крупные же полипептиды могут содержать и более 100 аминокислот. Она не просто вытянута в пространстве, а организована в трехмерную структуру. Поэтому существует понятие о 4-х уровнях пространственной организации (конформации) белка, а именно - первичной, вторичной, третичной и четвертичной структурах белковых молекул.
4.1. ПЕРВИЧНАЯ СТРУКТУРА
Первичная структура белка - последовательность аминокислотных фрагментов, прочно соединенных пептидными связями. Формируется за счет COOH-группы одной аминокислоты и NH2-группы соседней аминокислоты (рис. 5).

Рис. 5. Пептидная связь между молекулами аминокислот.
Хотя пептидная связь довольно прочная, ее сравнительно легко можно разрушить химическим путем – кипячением белка в крепком растворе кислоты или щелочи в течении 1-3 суток. Первичная структура закодирована в структурных генах.
4. 2. ВТОРИЧНАЯ СТРУКТУРА
Вторичная структура - это пространственная организация стержня полипептидной цепи. Существуют 3 главнейших типа вторичной структуры:
-
Альфа-спираль - имеет определенные характеристики: ширину, расстояние между двумя витками спирали. Для белков характерна правозакрученная спираль. В этой спирали на 10 витков приходится 36 аминокислотных остатков. У всех пептидов, уложенных в такую спираль, эта спираль абсолютно одинакова. Фиксируется альфа-спираль с помощью водородных связей между NH-группами одного витка спирали и С=О группами соседнего витка. Эти водородные связи расположены параллельно оси спирали и многократно повторяются, поэтому прочно удерживают спиралеобразную структуру. Более того, удерживают в несколько напряженном состоянии (как сжатую пружину) (рис. 6).

Рис. 6. Альфа-спираль вторичной структуры белка.
-
Бета-складчатая структура (структура складчатого листа). Фиксируется также водородными связями между С=О и NH-группами. Фиксирует два участка полипептидной цепи. Эти цепи могут быть параллельны или антипараллельны. Если такие связи образуются в пределах одного пептида, то они всегда антипараллельны, а если между разными полипептидами, то параллельны (рис. 7)..
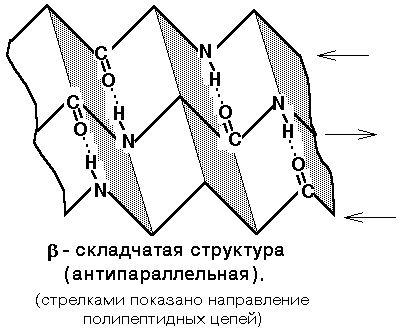
Рис. 7. Бета-складчатая структура белка.
-
Нерегулярная структура - тип вторичной структуры, в котором расположение различных участков полипептидной цепи относительно друг друга не имеет регулярного (постоянного) характера, поэтому нерегулярные структуры могут иметь различную конформацию.
4.3. ТРЕТИЧНАЯ СТРУКТУРА
Трехмерная архитектура полипептидной цепи – особое взаимное расположение в пространстве спиралеобразных, складчатых и нерегулярных участков полипептидной цепи.
Стабилизируют эту структуру 4 типа внутримолекулярных связей:
1 ковалентные дисульфидные связи между остатками цистеина;
2 нековалентные водородные связи (между С=О и – ОН, –NH2, –SH-группами);
3 электростатическое взаимодействие заряженных групп в боковых радикалах аминокислот (NН3+ и СОО-);
4 гидрофобные ван-дер-ваальсовые взаимодействия между неполярными боковыми радикалами аминокислот.
Выделяют два общих типа третичной структуры:
-
В фибриллярных белках (например, коллаген, эластин) молекулы которых имеют вытянутую форму и обычно формируют волокнистые структуры тканей, третичная структура представлена либо тройной альфа-спиралью (например, в коллагене), либо бета-складчатыми структурами (рис. 8).
2) В глобулярных белках, молекулы которых имеют форму шара или эллипса (латинское название: GLOBULA - шар), встречается сочетание всех трех типов структур: всегда есть нерегулярные участки, есть бета-складчатые структуры и альфа-спирали (например, инсулин) (рис. 8).
Третичная структура определяет нативные свойства белка.
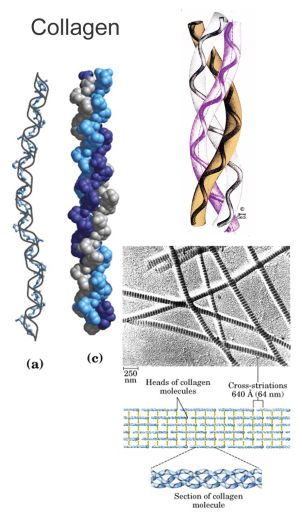
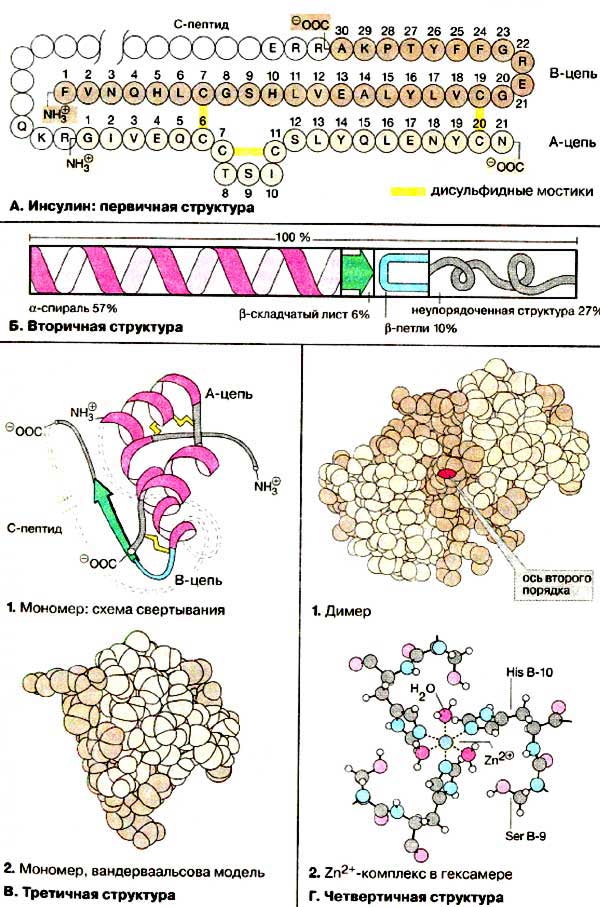
Рис. 8. Молекулы коллагена и инсулина.
4.4. ЧЕТВЕРТИЧНАЯ СТРУКТУРА
Встречается не у всех белков, а только у тех, которые состоят из двух или более полипептидных цепей. Каждая такая цепь называется субъединицей (протомером). Белки, обладающие четвертичной структурой, называют олигомерными ("олиго" - несколько) белками. Это означает, что они построены из нескольких субъединиц. В состав белковой молекулы могут входить одинаковые или разные субъединицы. Например, молекула гемоглобина «А» состоит из двух субъединиц одного типа и двух субъединиц другого типа, то есть является тетрамером (рис. 9). Субъединицы связаны между собой ионными, водородными, дисульфидными связями.
Четвертичная структура - это способ укладки в пространстве нескольких полипептидных цепей, обладающих первичной, вторичной и третичной структурами, которые могут быть как одинаковыми, так и разными. Примеры белков, обладающих четвертичной структурой: гемоглобин - 4 субъединицы; пируватдегидрогеназа - 72 субъединицы.
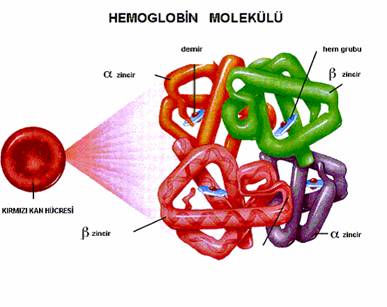
Рис. 9. Молекула гемоглобина.
5. ФУНКЦИИ БЕЛКОВ
Разнообразие белковых молекул определяет многообразие их функций.
-
Каталитическая (ферментная) – каталитическая функция белков осуществляется с помощью специфических белков – катализаторов. Они ускоряют скорость биохимических реакций в десятки и сотни миллионов раз.
-
Сократительная (актин, миозин – основные мышечные белки).
-
Структурная (тубулины – белки микротрубочек, входящих в состав цитоскелета, керотины роговых структур).
-
Транспортная (транспортные белки биомембран; сывороточные альбумины).
-
Защитная (антитела)
-
Рецепторная (мембранные, цитоплазматические и ядерные рецепторы для гормонов; рецепторы для вирусов)
-
Регуляторная (пептидные гормоны: инсулин, гормон роста и др.).
-
Трофическая (белок эндосперма семян; фосфопротеиды рыбьей икры).
-
Энергетическая (при полном окислении 1 г. белка освобождается 17,6 кДж энергии).
(Демонстрация флеш-анимации “Функции белков”).
V. Обобщение и систематизация материала, который изучался.
Преподаватель. Чтобы повторить и лучше запомнить главные моменты урока, закончите синквейн:
-
Белки
-
Сложные, нерастворимые
-
................
-
................
-
Жизнь.
VI. Подведение итогов.
Преподаватель. Таким образом, мы выяснили, что все белки – биополимеры, мономерами которых являются остатки аминокислот, соединенных пептидной связью. Различают четыре уровня пространственной организации белков: первичную, вторичную, третичную и четвертичную. Белки способны к денатурации и ренатурации (изменению и восстановлению своих высших структур), деструкции (необратимому нарушению первичной структуры). Высаливание белков – это обратимый процесс выпадения белков в осадок в результате действия солей щелочных и щелочноземельных металлов. Разнообразные белки осуществляют различные функции.
В завершении урока поделитесь своими впечатлениями. Для этого продолжите предложения, посвященные сегодняшнему дню.
Сегодня я узнал … .
Я удивился … .
Теперь я умею … .
Я хотел бы … .
Мне понравилось…
Подведение итогов с оцениванием работы каждого учащегося, анализ работы на уроке, выставление оценок.
VII. Сообщение домашнего задания.
-
проработать материал учебника из темы “Белки: строение, свойства. Функции белков”. § 9, 10 (учебник П. Г. Балан, Ю. Г. Вервес, В. П. Полищук).
-
написать эссе на тему: “Белок – основа жизни”.
- Международный вебинар «Лицевая гимнастика: комплексы упражнений, подготовка и методика проведения»
- Вебинар «Зрительная гимнастика как здоровьесберегающая технология в работе с дошкольниками и школьниками: методика проведения комплексов упражнений»
- Вебинар «Краеведческая работа библиотек как средство интеграции в социокультурное пространство региона: традиционные формы, новые технологии»
- Вебинар «ТРИЗ-технология как средство развития творческого мышления и воображения дошкольников»
- Вебинар «Рисование ребром ладони как нетрадиционная техника рисования в работе с дошкольниками и младшими школьниками»
- Вебинар «Рисование газетами как нетрадиционная техника изобразительной деятельности в работе с дошкольниками и младшими школьниками»