Разработка
урока физики в 10 классе по теме: «Газовые
законы»
Разработка
урока физики в 10 классе по теме: «Газовые
законы»
Учитель: Машенков Павел Васильевич
Школа: МБОУ «Белоусовская СОШ» Сакмарского района Оренбургской области
Тип урока: комбинированный
Цель урока: Осознание и осмысление учащимися газовых законов
Задачи:
-
Образовательные: изучить газовые законы; изображать графики изопроцессов; сформировать умения выделять и описывать изопроцессы; начать обучение учащихся решать графические и аналитические задачи, используя уравнение состояния и газовые законы.
-
Воспитательные: продолжить формирование познавательного интереса учащихся; стремления глубокого усвоения теоретических знаний через решение задач; умения слушать товарищей, аргументировать свою точку зрения.
-
Развивающие: активизация мыслительной деятельности, формирование логического и алгоритмического мышления; совершенствование навыков исследовательской деятельности; формирование качеств личности: самостоятельность, внимательность, критичность, объективность.
Оснащение урока: компьютер, проектор, экран, презентация по теме урока, задания
группам, баллончик газа для зажигалок, не заправленная зажигалка.
Ход урока
-
Организационный момент (1 мин.)
Попробуй пар не выпускать -
И чайник может бомбой стать
В. Марков
-
Проверка домашнего задания (4 мин.)
- самопроверка по слайду презентации решение задач №4, 6 из упр.13;
- повторение в форме фронтального опроса с записью на доске формул:
|
Вопрос |
Ответ |
|
Что мы называем идеальным газом? |
Идеальный газ – это газ, взаимодействие, между молекулами которого пренебрежительно мало. |
|
Какое уравнение называют уравнением состояния данного вещества? |
Уравнение, выражающее связь между макроскопическими параметрами состояния вещества, называется уравнением состояния этого вещества. |
|
Записать уравнение состояния идеального газа в классическом виде. |
pV/T=mR/М Уравнение Клапейрона - Менделеева |
|
Как правильно записать уравнение Клапейрона? |
p1V1/T1 = p2V2/T2 pV/T =const, при m =const. |
-
Целеполагание и мотивация (5 мин.)
Проблемная ситуация
Демонстрация заправки зажигалки газом из баллончика, учащиеся на ощупь убеждаются в понижении температуры баллончика.
«А почему?»
«Какой макроскопический параметр не меняется?»
«Как тогда лучше представить уравнение Клапейрона?»
pV/T =const ----------------------> pV/T =const, при V= const
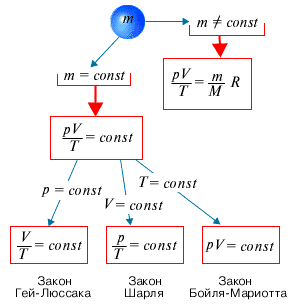
Ни один термодинамический параметр нельзя изменить, не затронув один, в то и два других параметра. Бывает так, что газ данной массы переходит из одного состояния в другое, изменяя только два параметра, оставляя третий неизменным. Такой переход называется изопроцессом, а уравнение его закономерности - газовым законом.
Изопроцесс – процесс, при котором масса газа и один из его термодинамических параметров остаются неизменными.
Газовый закон – количественная зависимость между двумя термодинамическими параметрами газа при фиксированном значении третьего.
Газовых закона, как и изопроцесса – три. Используя уравнение состояния идеального газа, можно вывести все три закона за 10 минут. Но в истории физики эти открытия были сделаны в обратном порядке: сначала экспериментально были получены газовые законы, и только потом они были обобщены в уравнение состояния. Этот путь занял почти 200 лет: первый газовый закон был получен в 1662 году физиками Бойлем и Мариоттом, уравнение состояния – в 1834 году Клапейроном, а более общая форма уравнения – в 1874 году Д.И.Менделеевым.
- «Итак, сформулируйте тему урока !»
(- газовые законы)
- «Какова основная познавательная задача урока?»
( - Изучить зависимость между двумя параметрами состояния газа при постоянном третьем)
-
Актуализация (2 мин.)
- Какие макроскопические параметры характеризуют состояние газа?
- Сколько может быть различных процессов изменения состояния газа, когда
меняются только два его макроскопических параметра?
- Как называются эти процессы?
- Сколько газовых законов мы сегодня изучим?
-
Первичное усвоение материала (4 мин.)
Изотермический процесс – процесс изменения состояния термодинамической системы при постоянной температуре.
Для идеального газа изотермический процесс описывается законом Бойля-Мариотта.
Закон установлен экспериментально до создания молекулярно-кинетической теории газов английским физиком Робертом Бойлем в 1662 году и французским аббатом Эдмоном Мариоттом, который описал независимо от Бойля аналогичные опыты в 1676 году.
Закон Бойля-Мариотта (изотермический процесс, T=const)
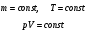
Для газа данной массы при постоянной температуре произведение давления на объем постоянно.
V р р
Т1>Т2
V
Т1
Т2
0 Т Т 0 0
изотермы
Закон Бойля-Мариотта справедлив для любых газов, а так же и для их смесей, например, для воздуха. Лишь при давлениях, в несколько сотен раз больших атмосферного, отклонения от этого закона становятся существенными.
Изотермическим можно приближенно считать процесс медленного сжатия воздуха или расширения газа под поршнем насоса при откачке его из сосуда. Правда температура газа при этом меняется, но в первом приближении этим изменением можно пренебречь.
Однако газовые законы активно работают не только в технике, но и в живой природе, широко применяются в медицине.
Закон Бойля-Мариотта начинает «работать на человека» (как, впрочем, и на любое млекопитающее) с момента его рождения, с первого самостоятельного вздоха.
При дыхании межреберные мышцы и диафрагма периодически изменяют объем грудной клетки. Когда грудная клетка расширяется, давление воздуха в легких падает ниже атмосферного, т.е. «срабатывает» изотермический закон (pV=const), и в следствие образовавшегося перепада давлений происходит вдох. Другими словами воздух идет из окружающей среды в легкие самотеком до тех пор, пока величины давления в легких и в окружающей среде не выровняются.
Выдох происходит аналогично: вследствие уменьшения объема легких давление воздуха в них становится больше, чем внешнее атмосферное, и за счет обратного перепада давлений он переходит наружу.
-
Самостоятельная работа учащихся в группах (12 мин.)
Учащиеся делятся на две группы. Группам предлагается рассмотреть оставшиеся изопроцессы, сформулировать и записать в виде формулы газовые законы, построить соответствующие графики. Для выполнения задания на слайде им предложен порядок работы и печатный вариант исторической справки. В каждой группе выбирается руководитель и пресс-атташе.
План выступления учащихся:
1. Название изопроцесса.
2. Вывод закона.
3. Название закона.
4. Графики.
5. Историческая справка.
6. Примеры проявления изопроцесса в природе и технике.
-
Осознание и осмысление учебной информации (3 мин.)
Просмотрев модели процессов, учащиеся объясняют газовые законы с молекулярной точки зрения.
Учащиеся с помощью учителя делают вывод об условиях и границах применения газовых законов.
-
Закрепление учебного материала (10 мин.)
1. Даны графики процессов в различных системах координат
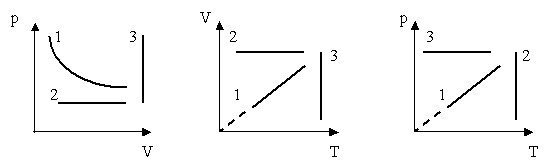
Найти во всех трех системах координат:
-
Изотермы;
-
Изохоры;
-
Изобары.
2. Чем отличаются состояния А и Б газа данной массы (рис.)?
р
Б А
0 Т
3. При температуре 27оС давление газа в закрытом сосуде было 75кПа. Каким будет давление этого газа при температуре – 13оС?
|
Дано: V=const t1=27oC p1=75кПа t2=-13oC |
300oK 75∙103Па 263oC |
|
p2 – ? |
Решение:
По закону Шарля: р/Т=const.
р1/Т1= р2/Т2,
р1Т2=р2Т1,
р2=р1Т2/Т1,
р2=75∙103∙263/300=65кПа.
Ответ: 65кПа.
-
Рефлексия (2 мин.)
Самостоятельное заполнение учащимися таблицы с последующей самопроверкой.
|
Название процесса |
Название закона |
Постоянный параметр |
Связь между другими параметрами |
Графики процессов в системе координат p-V, p-T, V-T |
Объяснение связи на основе МКТ |
|
Изотермический |
|
|
|
|
|
|
Изобарный |
|
|
|
|
|
|
Изохорный |
|
|
|
|
|
-
Подведение итогов урока. Домашнее задание (2 мин.)
Выставление оценок за работу на уроке.
Дома: § 69. Стр.189 - примеры решения задач (конспект) Упр. 13 (2, 8)
Используемые ресурсы:
-
«Физика 10 класс» учебник для общеобразовательных учреждений. Г.А. Мякишев, Б.Б. Буховцев, Н.Н. Сотский. Москва «Просвещение» 2010
-
Анофрикова С.В. Методика преподавания физики в средней школе. М.: Просвещение 1987 г.
-
http://kotovskobraz.68edu.ru/MEROPRIAT/Seminar/Anisimova.htm
-
http://nsportal.ru/shkola/fizika/library/urok-po-teme-gazovye-zakony
- Вебинар «Игры-эксперименты с дошкольниками: воспитываем потребность в познавательном общении со взрослыми, стремление наблюдать, сравнивать, исследовать, устанавливать причинно-следственные связи (ФОП ДО)»
- Вебинар «Краеведческая работа библиотек как средство интеграции в социокультурное пространство региона: традиционные формы, новые технологии»
- Международный вебинар «Лицевая гимнастика: комплексы упражнений, подготовка и методика проведения»
- Международный вебинар «Приоритетные ориентиры в системе “государство – отдых – ребёнок”, принципиальные подходы к сфере отдыха и оздоровления детей, современные формы, методы и технологии организации отдыха и оздоровления детей»
- Международный вебинар «Создание безопасной образовательной среды в образовательной организации в рамках реализации федерального проекта “Цифровая образовательная среда”»
- Международный вебинар «Цифровые образовательные ресурсы, дистанционные образовательные технологии, электронное обучение в работе с обучающимися с нарушениями зрения»